网址:http://m.1010jiajiao.com/timu3_id_204139[举报]
(08龙岩一中模拟)(15分)在用FeSO4溶液与NaOH溶液反应制备白色的Fe(OH)2时,出现了“白色沉淀迅速转变为灰绿色,最后逐渐变成红褐色”的实验现象,如何解释出现灰绿色的现象,探究小组的同学产生了不同的观点:
①灰绿色物质就是红褐色的氢氧化铁跟白色的氢氧化亚铁的简单混合物;
②灰绿色物质是铁的一种新的氢氧化物,但其中不含Fe3+离子。
(1)验证观点①不正确的实验操作是: ,
验证观点②所需的试剂有: 。
(2)探究小组的同学在研究由Fe2+制备Fe(OH)2的过程中,甲、乙、丙、丁四位同学分别设计了如下4个实验方案:
甲方案:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备Fe(OH)2。
乙方案:应用钢铁吸氧腐蚀的原理,设计电池制备Fe(OH)2。
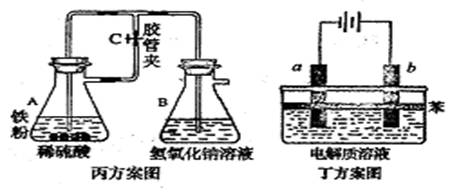
丙方案:按图实验,制备Fe(OH)2。
|
丁方案:按图实验,制备Fe(OH)2。
回答下列问题:
① 在甲方案中,所用FeSO4样品通常部分被氧化,写出在配制FeSO4溶液时,其操作过程:
② 在乙方案中,正极的电极反应式是: 。你认为该方案是否可行? 若不可行请说明理由(若可行,则该空不需回答):
③ 在丙方案中,当容器B、A中均加入试剂并塞好橡皮塞后,还需要进行的操作是 。
④ 在丁方案中,在两电极之间的溶液中首先观察到白色沉淀。请写a电极的电极反应式: 。则其电解质溶液可以是下列三项的 。
A.蒸馏水 B.NaC1溶液 C.NaOH溶液
查看习题详情和答案>>已知A、B为气体单质,其中一种为黄绿色;D为常见金属单质,C为化合物,它们间有下列转化关系:

(1)写出下列物质的化学式:A________;C________;
(2)写出C的水溶液与D反应的离子反应方程式________;
(3)F与D反应的离子反应方程式________.
(4)若对E溶液中的阳离子进行检验:
方法一:用NaOH溶液来检验E溶液中阳离子.①少取________置于试管中;②用胶头滴管取________加入试管中,现象为先产生白色沉淀,后变成灰绿色,最后变成红褐色;③结论:E溶液中含有某种阳离子
.方法二:请你参照“方法一”,用KSCN溶液来检验E溶液中的阳离子:
①____________;②向试管中滴入KSCN溶液两滴,无明显现象;③____________,现象为________________;④________________.
已知A、B均为可溶性正盐,A的水溶液为浅绿色,B为硫化物,在一定条件下A、B的溶液间可以发生如图所示的变化:
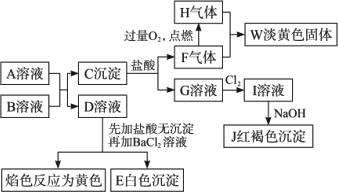
(1)写出下列物质的化学式:A________,D________.
(2)检验D溶液中所含的阴离子,能否滴加盐酸酸化的BaCl2溶液?请简述理由.
(3)写出下列变化的化学方程式(是离子反应的,写出离子方程式):
①F+H![]() W:________;
W:________;
②C沉淀+盐酸:________;
③G溶液与NaOH溶液反应开始得到的沉淀J:________.
(1)制造电路板的工艺中,FeCl3溶液可以蚀刻铜箔,请写出该反应的离子方程式
(2)已知铜与稀硫酸不反应,但将铜片在稀硫酸中长时间加热时溶液会呈蓝色,请用化学方程式表示原因
(3)氯化铝广泛用于有机合成和石油工业的催化剂.将铝土矿粉(主要成分为Al2O3)与焦炭混合后加热并通入氯气,可得到氯化铝,同时生成CO,写出该反应的化学方程式
(4)已知Cu2S可以和硝酸反应,请配平下列化学反应方程式:
□Cu2S+□HNO3
| ||
(5)在常温下,向0.10mol?L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=9时,c(Cu2+)=
(6)某校兴趣小组欲测定一种铁铝硅合金(FexAlySiz)粉末的组成,提出如下方案:准确称取1.46g该合金粉末,加入过量盐酸溶液充分反应后过滤,测定剩余固体质量0.07g.向滤液中滴加足量浓NaOH溶液,充分搅拌、过滤、洗涤得固体.再将所得固体充分加热、灼烧得红棕色粉末1.60g,通过计算确定此合金的组成为