摘要: (1) Cu 的质量分数 44% (2)溶液质量是 105.4 g 复习检测题(二)
网址:http://m.1010jiajiao.com/timu3_id_20314[举报]
小华想测定Cu-Ag合金和Cu-Zn合金中的Cu的质量分数,实验室只提供一瓶未标明质量分数的稀盐酸和必要的仪器.
(1)你认为能测出其中的Cu的质量分数的是 合金.
(2)小华取该合金32.5克与足量这种盐酸充分反应,经测定,产生了0.4克气体.该合金中的Cu的质量分数是 .
(3)想测定盐酸的质量分数,你认为实验时必须提供和测出的数据 (填编号)
A.参加反应的合金质量 B.参加反应的稀盐酸的质量
C.参加反应的稀盐酸的体积和密度 D.产生的气体的质量. 查看习题详情和答案>>
(1)你认为能测出其中的Cu的质量分数的是
(2)小华取该合金32.5克与足量这种盐酸充分反应,经测定,产生了0.4克气体.该合金中的Cu的质量分数是
(3)想测定盐酸的质量分数,你认为实验时必须提供和测出的数据
A.参加反应的合金质量 B.参加反应的稀盐酸的质量
C.参加反应的稀盐酸的体积和密度 D.产生的气体的质量. 查看习题详情和答案>>
(2013?东城区一模)金属是人类生活中的常用的材料.
(1)下列生活用品中,主要利用金属导热性的是

(2)工业上用赤铁矿(主要成分是氧化铁)冶炼铁的化学方程式是
(3)现有锌片、铜片、稀硫酸、硫酸锌溶液和硫酸铜溶液5种物质,某同学欲探究锌和铜的金属活动性顺序,选择的一组试剂是
(4)该同学查阅资料得知,铜锈的主要成分是碱式碳酸铜【Cu2(OH)2CO3】,他以铜锈为原料设计并完成如下实验(杂质不与稀硫酸反应,且不含铜元素.图中部分物质略去).
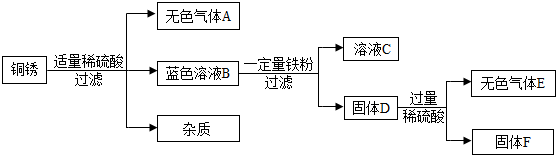
①溶液C中所含的溶质是
②已知铜锈中Cu2(OH)2CO3的质量分数是10%,固体F的质量是1.28g,则铜锈中含Cu的质量分数是
查看习题详情和答案>>
(1)下列生活用品中,主要利用金属导热性的是
AB
AB
(填字母序号).
(2)工业上用赤铁矿(主要成分是氧化铁)冶炼铁的化学方程式是
3CO+Fe2O3
2Fe+3CO2
| ||
3CO+Fe2O3
2Fe+3CO2
.
| ||
(3)现有锌片、铜片、稀硫酸、硫酸锌溶液和硫酸铜溶液5种物质,某同学欲探究锌和铜的金属活动性顺序,选择的一组试剂是
锌片、铜片、稀硫酸
锌片、铜片、稀硫酸
,其现象是锌片与稀硫酸反应有气体放出,铜片与稀硫酸没有气体放出
锌片与稀硫酸反应有气体放出,铜片与稀硫酸没有气体放出
.(4)该同学查阅资料得知,铜锈的主要成分是碱式碳酸铜【Cu2(OH)2CO3】,他以铜锈为原料设计并完成如下实验(杂质不与稀硫酸反应,且不含铜元素.图中部分物质略去).

①溶液C中所含的溶质是
FeSO4
FeSO4
.②已知铜锈中Cu2(OH)2CO3的质量分数是10%,固体F的质量是1.28g,则铜锈中含Cu的质量分数是
5.8%
5.8%
(结果精确至0.1%).有铁粉和铜粉的均匀混合物,甲、乙、丙三位同学分别取该混合物与稀硫酸反应,所得数据如下表所示:
请分析数据,回答下列问题:
(1)金属混合物中Cu的质量分数
(2)计算丙同学所得溶液中溶质的质量分数(计算结果精确到0.1%)
查看习题详情和答案>>
| 甲 | 乙 | 丙 | |
| 取用金属混合物的质量/g | 10 | 10 | 20 |
| 取用稀硫酸的质量/g | 100 | 120 | 100 |
| 反应后过滤,得干燥固体的质量/g | 4 | 4 | 13 |
(1)金属混合物中Cu的质量分数
(2)计算丙同学所得溶液中溶质的质量分数(计算结果精确到0.1%)
现有Cu与另一种金属(可能是Mg、Fe、Zn中的一种)形成的粉末.现欲测定其组成,进行如下实验:取该粉末16g放入烧杯,将溶质质量分数为14%的稀硫酸280.0g分4次加入该烧杯中,充分反应后,测得剩余的固体质量数据记录如下:
计算(要求写出计算过程):
(1)该粉末中Cu的质量分数.
(2)该粉末中另一种金属为何种金属.
(3)第3次加入稀硫酸充分反应后,所得溶液中溶质的质量分数.
查看习题详情和答案>>
| 次数 | 1 | 2 | 3 | 4 |
| 加入稀硫酸质量/g | 70.0 | 70.0 | 70.0 | 70.0 |
| 剩余固体质量/g | 13.6 | 11.2 | 8.8 | 8.4 |
(1)该粉末中Cu的质量分数.
(2)该粉末中另一种金属为何种金属.
(3)第3次加入稀硫酸充分反应后,所得溶液中溶质的质量分数.
现有Cu与另一种金属(可能是Mg、Fe、Zn中的一种)形成的粉末。现欲测定其组成,进行如下实验:取该粉末16g放入烧杯,将溶质质量分数为14%的稀硫酸280.0g分4次加入该烧杯中,充分反应后,测得剩余的固体质量数据记录如下:
| 实验次数 | 1 | 2 | 3 | 4 |
| 加入稀硫酸质量/g | 70.0 | 70.0 | 70.0 | 70.0 |
| 剩余固体质量/g | 13.6 | 11.2 | 8.8 | 8.4 |
计算(要求写出计算过程):
(1)该粉末中Cu的质量分数。
(2)该粉末中另一种金属为何种金属。
(3)第3次加入稀硫酸充分反应后,所得溶液中溶质的质量分数。 查看习题详情和答案>>