题目内容
(2013?东城区一模)金属是人类生活中的常用的材料.
(1)下列生活用品中,主要利用金属导热性的是

(2)工业上用赤铁矿(主要成分是氧化铁)冶炼铁的化学方程式是
(3)现有锌片、铜片、稀硫酸、硫酸锌溶液和硫酸铜溶液5种物质,某同学欲探究锌和铜的金属活动性顺序,选择的一组试剂是
(4)该同学查阅资料得知,铜锈的主要成分是碱式碳酸铜【Cu2(OH)2CO3】,他以铜锈为原料设计并完成如下实验(杂质不与稀硫酸反应,且不含铜元素.图中部分物质略去).
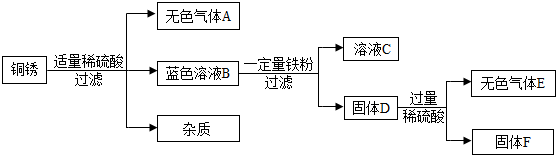
①溶液C中所含的溶质是
②已知铜锈中Cu2(OH)2CO3的质量分数是10%,固体F的质量是1.28g,则铜锈中含Cu的质量分数是
(1)下列生活用品中,主要利用金属导热性的是
AB
AB
(填字母序号).
(2)工业上用赤铁矿(主要成分是氧化铁)冶炼铁的化学方程式是
3CO+Fe2O3
2Fe+3CO2
| ||
3CO+Fe2O3
2Fe+3CO2
.
| ||
(3)现有锌片、铜片、稀硫酸、硫酸锌溶液和硫酸铜溶液5种物质,某同学欲探究锌和铜的金属活动性顺序,选择的一组试剂是
锌片、铜片、稀硫酸
锌片、铜片、稀硫酸
,其现象是锌片与稀硫酸反应有气体放出,铜片与稀硫酸没有气体放出
锌片与稀硫酸反应有气体放出,铜片与稀硫酸没有气体放出
.(4)该同学查阅资料得知,铜锈的主要成分是碱式碳酸铜【Cu2(OH)2CO3】,他以铜锈为原料设计并完成如下实验(杂质不与稀硫酸反应,且不含铜元素.图中部分物质略去).

①溶液C中所含的溶质是
FeSO4
FeSO4
.②已知铜锈中Cu2(OH)2CO3的质量分数是10%,固体F的质量是1.28g,则铜锈中含Cu的质量分数是
5.8%
5.8%
(结果精确至0.1%).分析:根据金属的性质进行分析,金属的导电性一般应用于制作导线,一氧化碳具有还原性,能将氧化铁还原为铁,要设计实验验证金属的活动性强弱,可以依据金属活动性顺序的意义进行,根据金属与盐溶液的反应特点进行分析解答即可.
解答:解:(1)铁锅是利用金属的导热性,铜制火锅是利用金属的导热性,铝制易拉罐是利用金属的延展性,故填:AB;
(2)一氧化碳具有还原性,能与氧化铁反应生成铁和二氧化碳,故填:3CO+Fe2O3
2Fe+3CO2;
(3)要设计实验验证锌和铜的活动性强弱,可以利用锌在氢前而铜在氢后,氢前金属能与稀硫酸反应产生氢气,而氢后金属不能与稀硫酸反应产生氢气的性质设计实验选择试剂,故填:锌片、铜片、稀硫酸 锌片与稀硫酸反应有气体放出,铜片与稀硫酸没有气体放出;
(4)铜锈能与稀硫酸反应生成二氧化碳和硫酸铜,硫酸铜能与铁反应生成硫酸亚铁和铜,故C中一定含有硫酸亚铁,得到的固体D能与酸反应生成气体,则D中含有铁和铜,得到的固体F是铜,在一个碱式碳酸铜分子中含有两个铜原子,故其质量关系为Cu2(OH)2CO3--2Cu,设碱式碳酸铜的质量为x
Cu2(OH)2CO3--2Cu
222 128
x 1.28g
=
x=2.22g
则铜锈的质量为:
=22.2g
故铜锈中铜元素的质量分数为:
×100%≈5.8%;
故填:①FeSO4 ②5.8%.
(2)一氧化碳具有还原性,能与氧化铁反应生成铁和二氧化碳,故填:3CO+Fe2O3
| ||
(3)要设计实验验证锌和铜的活动性强弱,可以利用锌在氢前而铜在氢后,氢前金属能与稀硫酸反应产生氢气,而氢后金属不能与稀硫酸反应产生氢气的性质设计实验选择试剂,故填:锌片、铜片、稀硫酸 锌片与稀硫酸反应有气体放出,铜片与稀硫酸没有气体放出;
(4)铜锈能与稀硫酸反应生成二氧化碳和硫酸铜,硫酸铜能与铁反应生成硫酸亚铁和铜,故C中一定含有硫酸亚铁,得到的固体D能与酸反应生成气体,则D中含有铁和铜,得到的固体F是铜,在一个碱式碳酸铜分子中含有两个铜原子,故其质量关系为Cu2(OH)2CO3--2Cu,设碱式碳酸铜的质量为x
Cu2(OH)2CO3--2Cu
222 128
x 1.28g
| 222 |
| x |
| 128 |
| 1.28g |
则铜锈的质量为:
| 2.22g |
| 10% |
故铜锈中铜元素的质量分数为:
| 1.28g |
| 22.2g |
故填:①FeSO4 ②5.8%.
点评:本题考查了常见金属的应用,完成此题,可以依据金属的性质进行.进行有关的计算时,可以依据质量守恒定律进行.

练习册系列答案
相关题目

