摘要:27.同温同压下.有0.3molO2与0.2molO3.它们的质量之比为 .它们所含的原子数之比为 .它们的体积之比为 .它们的密度之比为 . (2)现有一定条件下CO2 和 H2O 的混合气体37.5g.通过足量的Na2O2固体后.剩余的气体在标准状况的体积为11.2L.则:混合气体中CO2的物质的量为 mol.混合气体中H2O 的质量为 g.
网址:http://m.1010jiajiao.com/timu3_id_203128[举报]
 如图装置可用于多项定量实验.图中夹持固定装置已略去,甲有刻度,供量气用.
如图装置可用于多项定量实验.图中夹持固定装置已略去,甲有刻度,供量气用.( 1 )装置中有刻度的甲管可以用
碱式滴定管
碱式滴定管
代替 (填仪器名称),按图连接好装置后,检查装置气密性的方法是向乙中注入适量的水,使乙中液面高于甲中液面,静止观察,若液面差保持不变,则气密性良好
向乙中注入适量的水,使乙中液面高于甲中液面,静止观察,若液面差保持不变,则气密性良好
( 2 )某实验小组用镁粉、盐酸、醋酸设计实验来证明:在同温同压下,当上述两种酸的物质的量相同时,与镁粉反应生成氢气的体积相同而反应速率不同.装置如图所示,
有关实验数据记录于下表:
| 酸溶液 | 酸溶液 | 气体体积/mL | 反应时间 | |
| (实验A) | (实验B) | (25℃、101 kPa) | 实验A | 实验B |
| CH3COOH0.1 mol/L40.00mL | HCl溶液 0.1 mol/L 40.00mL |
5 | t(a1)=155 s | t(b1)=7 s |
| 10 | t(a2)=310 s | t(b2)=16 s | ||
| 15 | t(a3)=465 s | t(b3)=30 s | ||
| 20 | t(a4)=665 s | t(b4)=54 s | ||
| … | … | … | ||
①每次实验至少需要用电子天平(能称准1mg) 称取镁粉
0.048
0.048
g;②冷却到25℃后,在读取气体体积时,首先应如何操作:
上下移动乙管,使甲管中液面和乙管中液面相平,再读数
上下移动乙管,使甲管中液面和乙管中液面相平,再读数
;③分析实验数据,t(a1)远远大于t(b1)的原因是
开始阶段醋酸溶液中的c(H+)远小于相同浓度的盐酸中的c(H+)
开始阶段醋酸溶液中的c(H+)远小于相同浓度的盐酸中的c(H+)
.(3)用图示装置,某同学设计了测定镀锌铁皮镀层厚度的实验方案,将单侧面积为S cm2、质量为mg的镀锌铁皮与6mol?L-1 NaOH溶液反应.回答下列问题:(已知锌的密度为 ρ g/cm3)
①写出Zn镀层与NaOH溶液反应的离子方程式
Zn+2OH-+2H2O=Zn(OH)42-+H2↑
Zn+2OH-+2H2O=Zn(OH)42-+H2↑
②为提高测定的准确性,需将锥形瓶上的单孔橡胶塞换为双孔橡胶塞,另一孔插入
分液漏斗
分液漏斗
(填仪器名称)实验时先向锥形瓶中加入镀锌铁皮样品,塞上双孔塞,再加入NaOH溶液;
③已知实验前后甲管中液面读数差为V mL(实验条件的气体摩尔体积为Vm mol?L-1).则镀锌铁皮的锌镀层厚度为
| 65V×10-3 |
| 2ρSVm |
| 65V×10-3 |
| 2ρSVm |
某小组为证明同温同压下,同浓度,同体积的酸性不同的两种二元酸与足量镁带反应时生成H2量相同而反应速率不同,装置如图.主要步骤如下:
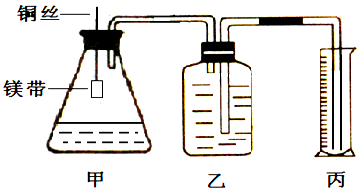
(1)配制浓度为0.5mol/L的硫酸和草酸溶液;
(2)用
(3)分别取去表面氧化膜的鎂带系于铜丝末端;
(4)检查装置气密性,乙中装满水,按图连接好装置;
(5)将铜丝下移,使足量鎂带浸如酸中(铜丝不与酸接触)至完全反应,同时记录
(6)反应结束时,读取量筒内水体积ymL.
将以上步骤补充完整并回答下列问题
(1)(4)中如何检查气密性
(2)用ρ=1.84 98.3%的浓硫酸配制250mL,c=0.5mol/L硫酸,主要仪器有
(3)读取量筒内水体积时,必须注意的问题是
(4)简述速率不等的原因
(5)此实验说明草酸为弱酸,请再设计一实验证明:
查看习题详情和答案>>

(1)配制浓度为0.5mol/L的硫酸和草酸溶液;
(2)用
酸式滴定管
酸式滴定管
量取10.00mL0.5mol/L的硫酸和草酸溶液分别加入两锥形瓶中;(3)分别取去表面氧化膜的鎂带系于铜丝末端;
(4)检查装置气密性,乙中装满水,按图连接好装置;
(5)将铜丝下移,使足量鎂带浸如酸中(铜丝不与酸接触)至完全反应,同时记录
反应所需时间
反应所需时间
;(6)反应结束时,读取量筒内水体积ymL.
将以上步骤补充完整并回答下列问题
(1)(4)中如何检查气密性
往丙中加水没过导气管口下端,两手掌紧贴甲外壁一会儿,若观察到丙中导气管冒气泡,表明装置不漏气.
往丙中加水没过导气管口下端,两手掌紧贴甲外壁一会儿,若观察到丙中导气管冒气泡,表明装置不漏气.
;(2)用ρ=1.84 98.3%的浓硫酸配制250mL,c=0.5mol/L硫酸,主要仪器有
250mL容量瓶
250mL容量瓶
、胶头滴管
胶头滴管
、烧杯、玻璃棒、酸式滴定管等;(3)读取量筒内水体积时,必须注意的问题是
读数时保持乙丙中液面相平;待装置冷却至室温再读数
读数时保持乙丙中液面相平;待装置冷却至室温再读数
;(4)简述速率不等的原因
H+浓度不同
H+浓度不同
,铜丝不能与酸接触的原因与铜易形成原电池,加快反应速率,干扰实验测定
与铜易形成原电池,加快反应速率,干扰实验测定
;(5)此实验说明草酸为弱酸,请再设计一实验证明:
测定草酸钠溶液的PH,如大于7,则为弱酸
测定草酸钠溶液的PH,如大于7,则为弱酸
.(2011?石景山区一模)烯烃中碳碳双键是重要的官能团,在不同条件下能发生多种变化.
已知①烯烃在催化剂作用下的复分解反应就是两种烯烃交换双键两端的基团,生成两种新烯烃的反应.
②烯烃与酸性高锰酸钾溶液反应的氧化产物有如下的对应关系:
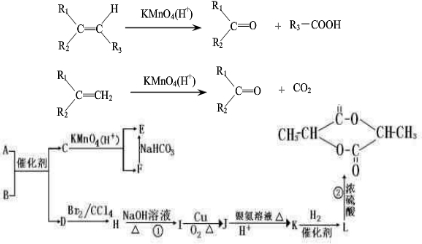
上述转化关系图中的物质:A和B都属于烃类,F是安息香酸,其蒸气密度是同温同压下H2密度的61倍,将0.61g F完全燃烧,产物通入足量的澄清石灰水中,产生3.5g沉淀.
根据以上信息回答下列问题:
(1)B的产量可以用来衡量一个国家石油化工发展的水平,B的名称是
(2)E的同体可用于人工降雨,E的电子式是
 .
.
(3)H→I的反应类型是
(4)L在一定条件下也可以生成一种高分子化合物W0 W可以作为手术的缝合线,其优点之一就是免拆线可被人体吸收.用W制成的塑料饭盒可降解,是环境友好材料.写出由L制W的化学方程式:
(5)A的结构简式为:
 (任写一个).
(任写一个).
(6)K物质的核磁共振氢谱图上有
(7)若将NaOH溶于I后再与H混合加热,反应生成的有机产物最多有
查看习题详情和答案>>
已知①烯烃在催化剂作用下的复分解反应就是两种烯烃交换双键两端的基团,生成两种新烯烃的反应.
②烯烃与酸性高锰酸钾溶液反应的氧化产物有如下的对应关系:

上述转化关系图中的物质:A和B都属于烃类,F是安息香酸,其蒸气密度是同温同压下H2密度的61倍,将0.61g F完全燃烧,产物通入足量的澄清石灰水中,产生3.5g沉淀.
根据以上信息回答下列问题:
(1)B的产量可以用来衡量一个国家石油化工发展的水平,B的名称是
乙烯
乙烯
.(2)E的同体可用于人工降雨,E的电子式是


(3)H→I的反应类型是
水解反应
水解反应
.(4)L在一定条件下也可以生成一种高分子化合物W0 W可以作为手术的缝合线,其优点之一就是免拆线可被人体吸收.用W制成的塑料饭盒可降解,是环境友好材料.写出由L制W的化学方程式:
nCH3CH(OH)COOH
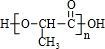 +(n-1)H2O
+(n-1)H2O
| 一定条件 |
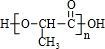 +(n-1)H2O
+(n-1)H2OnCH3CH(OH)COOH
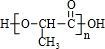 +(n-1)H2O
+(n-1)H2O
.| 一定条件 |
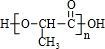 +(n-1)H2O
+(n-1)H2O(5)A的结构简式为:


(6)K物质的核磁共振氢谱图上有
2
2
个吸收峰.(7)若将NaOH溶于I后再与H混合加热,反应生成的有机产物最多有
5
5
种,写出住意两种物质的结构简式(同一个碳原子上连有两个碳碳双键的结构不稳定,可不考虑)CH3CBr=CH2
CH3CBr=CH2
、CH3-C≡CH
CH3-C≡CH
.(2009?南平二模)在一密闭容器中有如下反应:aX(g)+bY(g)?nW(g);△H=Q.某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图:

其中,ω(W)表示W在反应混合物中的百分含量,t表示反应时间.其它条 件不变时,下列分析正确的是( )
(1)图Ⅰ可能是不同压强对反应的影响,且P2>P1,a+b<n
(2)图Ⅲ可能是不同温度对反应的影响,且T1>T2,△H<0
(3)图Ⅱ可能是不同压强对反应的影响,且P1>P2,n<a+b
(4)图Ⅱ可能是在同温同压下催化剂对反应的影响,且1中使用的催化剂效果好.

其中,ω(W)表示W在反应混合物中的百分含量,t表示反应时间.其它条 件不变时,下列分析正确的是( )
(1)图Ⅰ可能是不同压强对反应的影响,且P2>P1,a+b<n
(2)图Ⅲ可能是不同温度对反应的影响,且T1>T2,△H<0
(3)图Ⅱ可能是不同压强对反应的影响,且P1>P2,n<a+b
(4)图Ⅱ可能是在同温同压下催化剂对反应的影响,且1中使用的催化剂效果好.
查看习题详情和答案>>
填写下列空白:
(1)34g NH3共有
(2)在标准状况下,35.5g Cl2的体积约是
(3)欲配制500mL 0.2mol/L Na2CO3溶液,需要用天平称量Na2CO3?10H2O晶体质量为
查看习题详情和答案>>
(1)34g NH3共有
8
8
mol原子,0.1molH2S共约有1.204×1023
1.204×1023
个氢原子.同温同压下,等体积的NH3和H2S气体的质量比为1:2
1:2
,含有的分子数目之比为1:1
1:1
.等质量的NH3和H2S中分子数目之比为2:1
2:1
.(2)在标准状况下,35.5g Cl2的体积约是
11.2
11.2
L,将其与氢气完全化合生成氯化氢需氢气的物质的量是0.5
0.5
mol,将生成的氯化氢气体溶于1000g水中,得到密度为a g?cm-3的盐酸,则该盐酸的物质的量浓度是(a/1.0365
1.0365
)mol/L.(3)欲配制500mL 0.2mol/L Na2CO3溶液,需要用天平称量Na2CO3?10H2O晶体质量为
28.6g
28.6g
.若从配好的上述溶液中取出50mL于一试剂瓶中,需要给它贴上标签,标签上的内容是0.2mol/L Na2CO3溶液
0.2mol/L Na2CO3溶液
;若再从中取出10mL溶液加水稀释至20mL,则此溶液中Na+的物质的量浓度为0.2mol/L
0.2mol/L
.