网址:http://m.1010jiajiao.com/timu3_id_202618[举报]
下列分析合理的是
A、氧化还原反应中,一种物质被氧化,另一种物质必然被还原
B、在氧化还原反应中金属单质只作还原剂
C、氧化还原反应的本质是元素化合价的升降
D、某无色溶液焰色反应呈黄色,说明溶液中只含钠元素
查看习题详情和答案>>
实验步骤如下:
(1)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有________。
(a)容量瓶________(b)烧杯________(c)烧瓶?
(2)步骤Ⅱ取样分析溶液中的Fe2+、Fe3+的含量,目的是________。?
(a)控制溶液中Fe2+与Fe3+含量比?
(b)确定下一步还原所需铁的量?
(c)确定氧化Fe2+所需NaClO3的量?
(d)确保铁的氧化物酸溶完全?
(3)用NaClO3氧化时反应方程式如下:?
6FeSO4+NaClO3+3H2SO4![]() 3Fe2(SO4)3+NaCl+3H2O
3Fe2(SO4)3+NaCl+3H2O
若改用HNO3氧化,则反应方程式如下?
6FeSO4+2HNO3+3H2SO4![]() 3Fe2(SO4)3+NO↑+4H2
3Fe2(SO4)3+NO↑+4H2
已知1 mol HNO3价格为0.16元、1 mol NaClO3价格为0.45元,评价用HNO3代替NaClO3作氧化剂的利弊,利是________,弊是________。
(4)聚合硫酸铁溶液中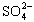 与Fe3+物质的量之比不是3∶2。根据下列供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中
与Fe3+物质的量之比不是3∶2。根据下列供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中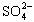 与Fe3+物质的量之比。?
与Fe3+物质的量之比。?
测定时所需的试剂________。?
(a) NaOH (b)FeSO4 (c) BaCl2 (d) NaClO3?
(5)需要测定________和________的质量(填写化合物的化学式)。?
(6)选出测定过程中所需的基本操作________(按操作先后顺序列出)。?
(a)萃取、分液 (b)过滤、洗涤 (c)蒸发、结晶 (d)冷却、称量 (e)烘干或灼烧?
查看习题详情和答案>>硫酸铁(PFS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理。用铁的氧化物为原料来制取聚合硫酸铁,为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe2+。?
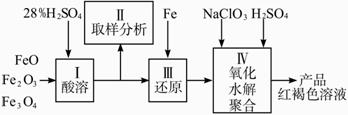
实验步骤如下:
(1)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有________。
(a)容量瓶________(b)烧杯________(c)烧瓶?
(2)步骤Ⅱ取样分析溶液中的Fe2+、Fe3+的含量,目的是________。?
(a)控制溶液中Fe2+与Fe3+含量比?
(b)确定下一步还原所需铁的量?
(c)确定氧化Fe2+所需NaClO3的量?
(d)确保铁的氧化物酸溶完全?
(3)用NaClO3氧化时反应方程式如下:?
6FeSO4+NaClO3+3H2SO4![]() 3Fe2(SO4)3+NaCl+3H2O
3Fe2(SO4)3+NaCl+3H2O
若改用HNO3氧化,则反应方程式如下?
6FeSO4+2HNO3+3H2SO4![]() 3Fe2(SO4)3+NO↑+4H2
3Fe2(SO4)3+NO↑+4H2
已知1 mol HNO3价格为0.16元、1 mol NaClO3价格为0.45元,评价用HNO3代替NaClO3作氧化剂的利弊,利是________,弊是________。
(4)聚合硫酸铁溶液中SO42-与Fe3+物质的量之比不是3∶2。根据下列供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中SO42-与Fe3+物质的量之比。?
测定时所需的试剂________。?
(a) NaOH (b)FeSO4 (c) BaCl2 (d) NaClO3?
(5)需要测定________和________的质量(填写化合物的化学式)。?
(6)选出测定过程中所需的基本操作________(按操作先后顺序列出)。?
(a)萃取、分液 (b)过滤、洗涤 (c)蒸发、结晶 (d)冷却、称量 (e)烘干或灼烧?
查看习题详情和答案>>硫酸铁(PFS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理.用铁的氧化物为原料来制取聚合硫酸铁,为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe2+.
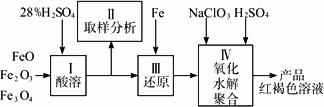
实验步骤如下:
(1)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有________.
(a)容量瓶________(b)烧杯________(c)烧瓶
(2)步骤Ⅱ取样分析溶液中的Fe2+、Fe3+的含量,目的是________.
(a)控制溶液中Fe2+与Fe3+含量比
(b)确定下一步还原所需铁的量
(c)确定氧化Fe2+所需NaClO3的量
(d)确保铁的氧化物酸溶完全
(3)用NaClO3氧化时反应方程式如下:
6FeSO4+NaClO3+3H2SO4→3Fe2(SO4)3+NaCl+3H2O
若改用HNO3氧化,则反应方程式如下
6FeSO4+2HNO3+3H2SO4→3Fe2(SO4)3+NO↑+4H2
已知1 mol HNO3价格为0.16元、1 mol NaClO3价格为0.45元,评价用HNO3代替NaClO3作氧化剂的利弊,利是________,弊是________.
(4)聚合硫酸铁溶液中![]() 与Fe3+物质的量之比不是3∶2.根据下列供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中
与Fe3+物质的量之比不是3∶2.根据下列供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中![]() 与Fe3+物质的量之比.
与Fe3+物质的量之比.
测定时所需的试剂________.
(a)NaOH (b)FeSO4 (c)BaCl2 (d)NaClO3
(5)需要测定________和________的质量(填写化合物的化学式).
(6)选出测定过程中所需的基本操作________(按操作先后顺序列出).
(a)萃取、分液 (b)过滤、洗涤 (c)蒸发、结晶 (d)冷却、称量 (e)烘干或灼烧
硫酸铁(PFS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理.用铁的氧化物为原料来制取聚合硫酸铁,为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe2+.
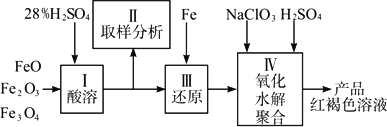
实验步骤如下:
(1)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有________.
(a)容量瓶________(b)烧杯________(c)烧瓶
(2)步骤Ⅱ取样分析溶液中的Fe2+、Fe3+的含量,目的是________.
(a)控制溶液中Fe2+与Fe3+含量比
(b)确定下一步还原所需铁的量
(c)确定氧化Fe2+所需NaClO3的量
(d)确保铁的氧化物酸溶完全
(3)用NaClO3氧化时反应方程式如下:
6FeSO4+NaClO3+3H2SO4![]() 3Fe2(SO4)3+NaCl+3H2O
3Fe2(SO4)3+NaCl+3H2O
若改用HNO3氧化,则反应方程式如下
6FeSO4+2HNO3+3H2SO4![]() 3Fe2(SO4)3+NO↑+4H2
3Fe2(SO4)3+NO↑+4H2
已知1 mol HNO3价格为0.16元、1 mol NaClO3价格为0.45元,评价用HNO3代替NaClO3作氧化剂的利弊,利是________,弊是________.
(4)聚合硫酸铁溶液中SO2-4与Fe3+物质的量之比不是3∶2.根据下列供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中SO2-4与Fe3+物质的量之比.
测定时所需的试剂________.
(a)NaOH (b)FeSO4 (c)BaCl2 (d)NaClO3
(5)需要测定________和________的质量(填写化合物的化学式).
(6)选出测定过程中所需的基本操作________(按操作先后顺序列出).
(a)萃取、分液 (b)过滤、洗涤 (c)蒸发、结晶 (d)冷却、称量 (e)烘干或灼烧