摘要:17.将5 mL 0.2 mol/LAgNO3溶液与10 mL 0.15 mol/L BaCl2溶液混合.反应后.溶液中离子浓度最大的是( ). A.Cl- B.NO3- C.Ba2+ D.Ag+
网址:http://m.1010jiajiao.com/timu3_id_201686[举报]
常温下,下列溶液中各微粒浓度关系或pH判定不正确的是
A.将5 mL 0.02 mol/L的H2SO4溶液与5 mL 0.02 mol/L NaOH溶液充分混合,若混合后溶液的体积为10 mL,则混合液的pH=2
B.某物质的溶液中由水电离的c(H+) = 1×10-a mol/L,若a>7,则pH一定为14-a
C.pH相等的①CH3COONa ②C6H5ONa ③NaHCO3溶液中,c(Na+)大小关系:①>③>②
D.CH3COONa溶液中加入少量KNO3固体后的碱性溶液一定有:
c(Na+) + c(H+) = c(CH3COO-) + c(OH-)
查看习题详情和答案>>
下图中A、B均为固体,其中B为单质。下图可用于工业生产F,F是衡量一个国家化工水平的标志。回答下列问题
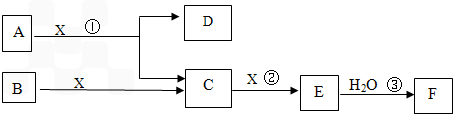
(1)A的化学式 ___________
(2)反应①是一个氧化还原反应,该反应发生时,每生成4 mol气体C,转移电子_____mol
(3)写出D与铝单质反应的化学方程式 ___________________
(4)反应②是可逆反应,在2 L的密闭容器中投入4 molC和3 molX,10分钟后反应达到平衡,平衡时混合气体共6 mol,则下列说法正确的是________
A.工业制取F时,C和X生成E的反应是在吸收塔进行
B.这10分钟内,X的平均速率是0.1mol/( L·min)
C.当C和X的消耗速率比为2:1时,标志着反应达到平衡
D.平衡时C的转化率是50%
E.在工业生产中可以通过增加X的量来提高C的转化率
F.工业生产中直接用水来吸收E
(5)写出2.24L气体C与0.15mol氢氧化钠溶液反应的离子化学方程式_____________
(6)将5 mL 0.02mol/L的F溶液与5 mL 0.02 mol/LNaOH溶液充分混合,若混合后溶液的体积为10mL,则混合液的pH是_________写出F的一种用途_______________
查看习题详情和答案>>
(2)反应①是一个氧化还原反应,该反应发生时,每生成4 mol气体C,转移电子_____mol
(3)写出D与铝单质反应的化学方程式 ___________________
(4)反应②是可逆反应,在2 L的密闭容器中投入4 molC和3 molX,10分钟后反应达到平衡,平衡时混合气体共6 mol,则下列说法正确的是________
A.工业制取F时,C和X生成E的反应是在吸收塔进行
B.这10分钟内,X的平均速率是0.1mol/( L·min)
C.当C和X的消耗速率比为2:1时,标志着反应达到平衡
D.平衡时C的转化率是50%
E.在工业生产中可以通过增加X的量来提高C的转化率
F.工业生产中直接用水来吸收E
(5)写出2.24L气体C与0.15mol氢氧化钠溶液反应的离子化学方程式_____________
(6)将5 mL 0.02mol/L的F溶液与5 mL 0.02 mol/LNaOH溶液充分混合,若混合后溶液的体积为10mL,则混合液的pH是_________写出F的一种用途_______________
下图中A、B均为固体,其中B为单质。下图可用于工业生产F,F是衡量一个国家化工水平的标志。
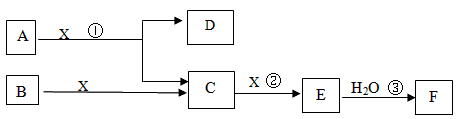
回答下列问题:
(1)A的化学式____________
(2)反应①是一个氧化还原反应,该反应发生时,每生成4 mol气体C,转移电子____________mol
(3)写出D与铝单质反应的化学方程式_____________
(4)反应②是可逆反应,在2 L的密闭容器中投入4 molC和3 molX,10分钟后反应达到平衡,平衡时混合气体共6 mol,则下列说法正确的是_____________
A.工业制取F时,C和X生成E的反应是在吸收塔进行
B.这10分钟内,X的平均速率是0.1mol/( L·min)
C.当C和X的消耗速率比为2:1时,标志着反应达到平衡
D.平衡时C的转化率是50% E.在工业生产中可以通过增加X的量来提高C的转化率
F.工业生产中直接用水来吸收E
(5)写出2.24L气体C与0.15mol氢氧化钠溶液反应的离子化学方程式______________。
(6)将5 mL 0.02mol/L的F溶液与5 mL 0.02 mol/LNaOH溶液充分混合,若混合后溶液的体积为10mL,则混合液的pH是__________写出F的一种用途_______________。
查看习题详情和答案>>
(1)A的化学式____________
(2)反应①是一个氧化还原反应,该反应发生时,每生成4 mol气体C,转移电子____________mol
(3)写出D与铝单质反应的化学方程式_____________
(4)反应②是可逆反应,在2 L的密闭容器中投入4 molC和3 molX,10分钟后反应达到平衡,平衡时混合气体共6 mol,则下列说法正确的是_____________
A.工业制取F时,C和X生成E的反应是在吸收塔进行
B.这10分钟内,X的平均速率是0.1mol/( L·min)
C.当C和X的消耗速率比为2:1时,标志着反应达到平衡
D.平衡时C的转化率是50% E.在工业生产中可以通过增加X的量来提高C的转化率
F.工业生产中直接用水来吸收E
(5)写出2.24L气体C与0.15mol氢氧化钠溶液反应的离子化学方程式______________。
(6)将5 mL 0.02mol/L的F溶液与5 mL 0.02 mol/LNaOH溶液充分混合,若混合后溶液的体积为10mL,则混合液的pH是__________写出F的一种用途_______________。
如图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去)。已知 化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业 原料。
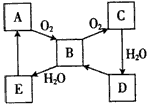
(1)A的化学式为____。
(2)写出一个由D转化成B的化学方程式:_____________。
(3)室温下,将5 mL 0.10 mol·L-1E溶液与10 mL 0.10 mol·L-1 NaOH溶液混合。
①反应后溶液的pH____(填“>”、“<”或“=”)7,理由是________(用离子方程式表 示)。
②将反应后的溶液露置于空气中足够长的时间,其pH将______(填“增大”、“减小”或“不变”),理由是 ______________________。
查看习题详情和答案>>
(2)写出一个由D转化成B的化学方程式:_____________。
(3)室温下,将5 mL 0.10 mol·L-1E溶液与10 mL 0.10 mol·L-1 NaOH溶液混合。
①反应后溶液的pH____(填“>”、“<”或“=”)7,理由是________(用离子方程式表 示)。
②将反应后的溶液露置于空气中足够长的时间,其pH将______(填“增大”、“减小”或“不变”),理由是 ______________________。