摘要:100mL浓度为0.3mol/L 的Na2SO3溶液恰好与50mL浓度为0.2mol/L的K2Cr2O7溶液完全反应(已知SO32— 被氧化成SO42—).则元素Cr在还原产物中的化合价为( ) A. 0 B.+2 C.+3 D.+6
网址:http://m.1010jiajiao.com/timu3_id_201081[举报]
实验室欲配制100mL浓度为0.5mol?L-1的NaOH溶液,有以下操作步骤:
①把称量好的NaOH固体放在小烧杯中加适量的蒸馏水溶解,并冷却至室温.
②将溶解冷却后的溶液小心地转移人容量瓶中.
③继续向容量瓶中加蒸馏水至距刻度线lcm~2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面最低点与刻度线相切.
④将容量瓶瓶塞塞紧,充分摇匀.
⑤用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次的洗涤液都小心转移人容量瓶,并轻轻摇匀.
请回答下列问题:
(1)需要称取NaOH固体的质量为
(2)配制NaOH溶液时,正确的操作顺序为(填写序号)
(3)在整个配制过程中,需要用到的仪器,除了烧杯、玻璃棒、胶头滴管外,还必须用到的是
(4)下列操作能使所配溶液浓度偏高的是
A.定容时俯视容量瓶的刻度线
B.向容量瓶中转移溶液时,有溶液洒落在容量瓶外
C.向容量瓶中滴加蒸馏水时,不慎超过了刻度线.
查看习题详情和答案>>
①把称量好的NaOH固体放在小烧杯中加适量的蒸馏水溶解,并冷却至室温.
②将溶解冷却后的溶液小心地转移人容量瓶中.
③继续向容量瓶中加蒸馏水至距刻度线lcm~2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面最低点与刻度线相切.
④将容量瓶瓶塞塞紧,充分摇匀.
⑤用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次的洗涤液都小心转移人容量瓶,并轻轻摇匀.
请回答下列问题:
(1)需要称取NaOH固体的质量为
2.0g
2.0g
.(2)配制NaOH溶液时,正确的操作顺序为(填写序号)
①②⑤③④
①②⑤③④
.(3)在整个配制过程中,需要用到的仪器,除了烧杯、玻璃棒、胶头滴管外,还必须用到的是
托盘天平、100mL容量瓶、药匙
托盘天平、100mL容量瓶、药匙
.(4)下列操作能使所配溶液浓度偏高的是
A
A
.A.定容时俯视容量瓶的刻度线
B.向容量瓶中转移溶液时,有溶液洒落在容量瓶外
C.向容量瓶中滴加蒸馏水时,不慎超过了刻度线.
下列仪器使用正确的是( )
| A、在表面皿蒸发浓缩Na Cl溶液 | B、用带玻璃塞的试剂瓶盛盐酸 | C、使用漏斗、滤纸、玻璃棒等进行过滤实验 | D、配制100mL浓度为0.10 mol?L-1Na Cl溶液时,在容量瓶中溶解、定容 |
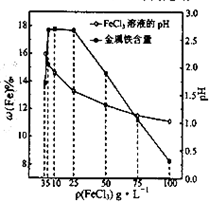 用氯化铁浸出重铬酸钾(K2Cr2O7)滴定法测定钛精粉试样中单质铁的质量分数[ω(Fe)%],实验步骤如下:
用氯化铁浸出重铬酸钾(K2Cr2O7)滴定法测定钛精粉试样中单质铁的质量分数[ω(Fe)%],实验步骤如下:步骤1:称取试样0.100g于250mL洗净的锥形瓶中.
步骤2:加入FeCl3溶液100mL,迅速塞上胶塞,用电磁搅拌器30min.
步骤3:过滤,用水洗涤锥形瓶和滤渣各3~4次,洗液全部并入滤液中.
步骤4:将滤液稀释至500mL,再移去100mL稀释液于锥形瓶中,加入20mL硫酸和磷酸的混合酸,加0.5%二苯胺磺酸钠指示剂4滴.
步骤5:以K2Cr2O7标准溶液滴定至出现明显紫色为终点.发生的反应为:Cr2O72-+6Fe2++14H+=2Cr3++Fe3++7H2O.
步骤6:重复测定两次.
步骤7:数据处理.
(1)步骤2中加入FeCl3溶液后锥形瓶中发生反应的离子方程式为
(2)步骤3中判断滤纸上残渣已洗净的方法是
(3)实验中需用到100mL浓度为0.01mol?L-1K2Cr2O7标准溶液,配置时用到的玻璃仪器有
(4)科研人员确定FeCl3溶液的最佳浓度,选用100mL不同浓度的FeCl3溶液(FeCl3溶液均过量)溶解同一钛精粉试样,其余条件控制相同,得到测定结果如图所示.则FeCl3溶液的浓度[用ρ(FeCl3)表示]范围应为
用2.4mol/L的H2SO4溶液配制100mL浓度为0.2mol/L的稀H2SO4,回答下列问题:
(1)需用量筒量取2.4mol/L的H2SO4溶液的体积是
(2)溶液配制的所需的基本步骤如下:

将上述实验步骤A到F按实验过程先后次序排列
(3)上述实验步骤A、B、E、F都用到的仪器名称为
(4)取上述所配溶液10mL与足量BaCl2溶液反应,生成白色沉淀0.48g.则该溶液浓度
a.定容时俯视容量瓶; b.用量筒取2.4mol/LH2SO4溶液时俯视读数;
c.容量瓶使用前未干燥;d.使用的烧杯和玻璃棒未洗涤彻底;e.定容时将蒸馏水洒在容量瓶外面.
查看习题详情和答案>>
(1)需用量筒量取2.4mol/L的H2SO4溶液的体积是
8.3
8.3
mL.(2)溶液配制的所需的基本步骤如下:

将上述实验步骤A到F按实验过程先后次序排列
CBDFAE
CBDFAE
.(3)上述实验步骤A、B、E、F都用到的仪器名称为
100mL容量瓶
100mL容量瓶
.(4)取上述所配溶液10mL与足量BaCl2溶液反应,生成白色沉淀0.48g.则该溶液浓度
大于
大于
0.2mol/L(填“大于”“等于”或“小于”),造成此误差的操作可能是a
a
.a.定容时俯视容量瓶; b.用量筒取2.4mol/LH2SO4溶液时俯视读数;
c.容量瓶使用前未干燥;d.使用的烧杯和玻璃棒未洗涤彻底;e.定容时将蒸馏水洒在容量瓶外面.