题目内容
 用氯化铁浸出重铬酸钾(K2Cr2O7)滴定法测定钛精粉试样中单质铁的质量分数[ω(Fe)%],实验步骤如下:
用氯化铁浸出重铬酸钾(K2Cr2O7)滴定法测定钛精粉试样中单质铁的质量分数[ω(Fe)%],实验步骤如下:步骤1:称取试样0.100g于250mL洗净的锥形瓶中.
步骤2:加入FeCl3溶液100mL,迅速塞上胶塞,用电磁搅拌器30min.
步骤3:过滤,用水洗涤锥形瓶和滤渣各3~4次,洗液全部并入滤液中.
步骤4:将滤液稀释至500mL,再移去100mL稀释液于锥形瓶中,加入20mL硫酸和磷酸的混合酸,加0.5%二苯胺磺酸钠指示剂4滴.
步骤5:以K2Cr2O7标准溶液滴定至出现明显紫色为终点.发生的反应为:Cr2O72-+6Fe2++14H+=2Cr3++Fe3++7H2O.
步骤6:重复测定两次.
步骤7:数据处理.
(1)步骤2中加入FeCl3溶液后锥形瓶中发生反应的离子方程式为
(2)步骤3中判断滤纸上残渣已洗净的方法是
(3)实验中需用到100mL浓度为0.01mol?L-1K2Cr2O7标准溶液,配置时用到的玻璃仪器有
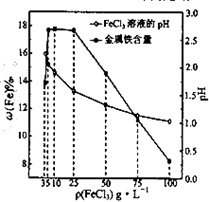
(4)科研人员确定FeCl3溶液的最佳浓度,选用100mL不同浓度的FeCl3溶液(FeCl3溶液均过量)溶解同一钛精粉试样,其余条件控制相同,得到测定结果如图所示.则FeCl3溶液的浓度[用ρ(FeCl3)表示]范围应为
分析:(1)钛精粉试样中含单质铁,加入氯化铁溶液反应生成氯化亚铁,迅速塞上胶塞防止生成的亚铁离子被氧气氧化;
(2)依据检验氯化铁溶液中的氯离子的存在分析判断是否洗涤干净;
(3)依据溶液配制的实验过程中的操作步骤分析选择所需仪器;若未烘干会增大标准液的体积,造成测定结果偏高,K2Cr2O7溶液是强氧化剂,能腐蚀橡胶管,应盛在酸式滴定管中;
(4)依据图象变化曲线分析,FeCl3溶液的浓度在5-25g/L时铁的质量分数最大,浓度低溶解速率慢,浓度高溶液酸性强和铁发生反应;
(2)依据检验氯化铁溶液中的氯离子的存在分析判断是否洗涤干净;
(3)依据溶液配制的实验过程中的操作步骤分析选择所需仪器;若未烘干会增大标准液的体积,造成测定结果偏高,K2Cr2O7溶液是强氧化剂,能腐蚀橡胶管,应盛在酸式滴定管中;
(4)依据图象变化曲线分析,FeCl3溶液的浓度在5-25g/L时铁的质量分数最大,浓度低溶解速率慢,浓度高溶液酸性强和铁发生反应;
解答:解:(1)钛精粉试样中含单质铁,加入氯化铁溶液反应生成氯化亚铁,反应的离子方程式为:2Fe3++Fe=3Fe2+,迅速塞上胶塞防止生成的亚铁离子被氧气氧化;
故答案为:2Fe3++Fe=3Fe2+,防止Fe2+被空气中的氧气氧化;
(2)依据检验氯化铁溶液中的氯离子的存在分析判断是否洗涤干净,实验设计方案为:取最后一次洗涤滤出液,滴加硝酸银溶液,若无白色沉淀证明已洗净;
故答案为:取最后一次洗涤滤出液,滴加硝酸银溶液,若无白色沉淀证明已洗净;
(3)溶液配制的实验过程中的操作步骤为计算,称量、溶解、转移、洗涤定容,选择所需玻璃仪器为烧杯、玻璃棒、100ml容量瓶、胶头滴管;若未烘干会增大标准液的体积,造成测定结果偏高,K2Cr2O7溶液是强氧化剂,能腐蚀橡胶管,应盛在酸式滴定管中;
故答案为:100ml容量瓶,烧杯,玻璃棒,胶头滴管,偏高,酸式滴定管;
(4)依据图象变化曲线分析,FeCl3溶液的浓度在5g/L-25g/L时铁的质量分数最大,测定误差小,浓度低时溶解速率慢,单质铁未全部反应,浓度高溶液酸性强和铁发生反应;
故答案为:5-25,浓度过低时溶解速率过慢,单质铁未完全反应;浓度过高时溶液酸性强,溶液中H+与单质铁反应;
故答案为:2Fe3++Fe=3Fe2+,防止Fe2+被空气中的氧气氧化;
(2)依据检验氯化铁溶液中的氯离子的存在分析判断是否洗涤干净,实验设计方案为:取最后一次洗涤滤出液,滴加硝酸银溶液,若无白色沉淀证明已洗净;
故答案为:取最后一次洗涤滤出液,滴加硝酸银溶液,若无白色沉淀证明已洗净;
(3)溶液配制的实验过程中的操作步骤为计算,称量、溶解、转移、洗涤定容,选择所需玻璃仪器为烧杯、玻璃棒、100ml容量瓶、胶头滴管;若未烘干会增大标准液的体积,造成测定结果偏高,K2Cr2O7溶液是强氧化剂,能腐蚀橡胶管,应盛在酸式滴定管中;
故答案为:100ml容量瓶,烧杯,玻璃棒,胶头滴管,偏高,酸式滴定管;
(4)依据图象变化曲线分析,FeCl3溶液的浓度在5g/L-25g/L时铁的质量分数最大,测定误差小,浓度低时溶解速率慢,单质铁未全部反应,浓度高溶液酸性强和铁发生反应;
故答案为:5-25,浓度过低时溶解速率过慢,单质铁未完全反应;浓度过高时溶液酸性强,溶液中H+与单质铁反应;
点评:本题考查了物质含量的实验分析验证,物质性质和实验基本操作是解题关键,题目难度中等.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目