网址:http://m.1010jiajiao.com/timu3_id_20077[举报]
为测定二氧化碳与氢氧化钠反应的产物,某化学学习小组的同学向一定量的NaOH溶液中通入一定量的CO2充分反应后,低温蒸发结晶,得到白色固体,对该白色固体的成分.
[资料卡]当二氧化碳过量时,碳酸钠也会与二氧化碳反应Na2CO3+CO2+H2O=2NaHCO3
Na2CO3+HCl=NaHCO3+NaCl; NaHCO3+HCl=NaCl+H2O+CO2↑;
NaHCO3+NaOH=Na2CO3+H2O; 2NaHCO3 Na2CO3+CO2↑+H2O;
Na2CO3+CO2↑+H2O;
Na2CO3和NaOH的热稳定性都较好.
[猜想与假设]该小组的同学进行了猜测:
(1)甲同学认为该白色固体可能是NaOH与Na2CO3的混合物.你认为该固体还可能是Na2CO3或______或______.
[实验设计]
(2)
| 实验操作 | 实验现象 | 结论 |
| (1)取一定质量的样品,加热 | 固体质量减少 | 一定有______ 一定无______ 可能有______ |
| (2)另取样品,向其中滴加稀盐酸 | 有气体产生 |
为测定二氧化碳与氢氧化钠反应的产物,某化学学习小组的同学向一定量的NaOH溶液中通入一定量的CO2充分反应后,低温蒸发结晶,得到白色固体,对该白色固体的成分。
[资料卡]当二氧化碳过量时,碳酸钠也会与二氧化碳反应Na2CO3+CO2+H2O=2NaHCO3
Na2CO3+HCl=NaHCO3+NaCl; NaHCO3+HCl=NaCl+H2O+CO2↑;
NaHCO3+NaOH=Na2CO3+H2O; 2NaHCO3 加热 Na2CO3+CO2↑+H2O;
Na2CO3和NaOH的热稳定性都较好。
[猜想与假设]该小组的同学进行了猜测:
(1)甲同学认为该白色固体可能是NaOH与Na2CO3的混合物。你认为该固体还可能是Na2CO3或____________或____________。
[实验设计]
(2)
| 实验操作 | 实验现象 | 结论 |
| (1)取一定质量的样品,加热 | 固体质量减少 | 一定有 一定无 可能有 |
| (2)另取样品,向其中滴加稀盐酸 | 有气体产生 |
现有一种Na2CO3和NaHCO3的混合物,某同学为测定其含量,取一定量的该样品溶于水,逐滴加入27.6%的稀盐酸并不断振荡,首先发生反应:Na2CO3+HCl=NaHCO3+NaCl,然后发生反应:NaHCO3+HCl=NaCl+CO2↑+H2O。
已知:实验测得产生的CO2的量与加入稀盐酸的数据如下图。
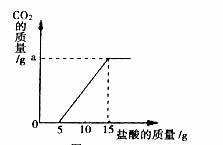
(1)当加入 g盐酸时,才开始产生CO2;
(2)原样品中Na2CO3的质量是多少?
(3)a的数值是 g。
查看习题详情和答案>>某研究性学习小组设计了测定纯碱(Na2CO3)样品(只含NaCl杂质)中Na2CO3质量分数的实验方案.请回答下列问题:
小资料:碱石灰的主要成分是氢氧化钠和氧化钙的混合物
(1)气体法。
【原理思路】利用Na2CO3与稀硫酸反应产生CO2,通过测量丙装置实验前后的质量得出CO2质量,从而计算碳酸钠的质量分数。(不考虑原装置内空气的影响)
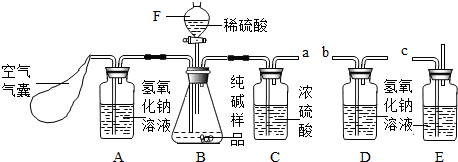
【实验分析】小科同学根据以上思路,设计了如下图的实验装置。
①实验装置乙中盛放的试剂为 。
装置丁中碱石灰的作用是 。(填字母)
A.吸收Na2CO3与稀硫酸反应产生CO2
B.防止外界空气中二氧化碳进入丙中
C.干燥二氧化碳
②实验中如果滴加稀硫酸的速度过快,会导致测得样品中碳酸钠的
质量分数 (填写“偏高”“偏低”或“不变”).
③小明同学认为小科的方案存在问题,即使操作规范下也会造成结果偏低,你认为他的理由是 ,应该将装置甲中双孔橡胶塞换成三孔橡胶塞,并增加下图装置,实验结束后缓缓通入一段时间空气,目的是 ,其中NaOH溶液的作用是 。
(2)沉淀法.
【实验原理】利用碳酸根离子与钙离子结合生成沉淀,通过沉淀的质量而得出碳酸钠的质量分数。
【实验步骤】①用托盘天平称取样品11.0g放入烧杯中,加水使其完全溶解;
②加入过量的CaCl2溶液充分反应。证明CaCl2过量(即Na2CO3已完全反应)的方法是: 静置,向上层清液中滴加 溶液,如果没有白色沉100%=96.4%淀生成,证明CaCl2过量;
③过滤、操作X、干燥、称量沉淀的质量为10.0g,操作X的名称是 ,如果缺少此操作会造成碳酸钠质量分数 (填写“偏高”“偏低”或“不变”)。
④通过以上提供的数据计算出样品中碳酸钠的质量分数为 。(写出计算过程,结果保留至0.1%)
实验原理:
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
通过实验测定反应产生的CO2的质量,即可求得原样品中Na2CO3的质量,进而求得Na2CO3在样品中的质量分数.
实验步骤:
①如图连接装置(管口a、b、c暂不连接),并加入所需药品.
②称量并记录装置D的质量(m1).(称量时注意封闭此装置)
③挤压空气气囊,持续约1分钟.
④连接管口a、b、c.
⑤打开分液漏斗F的活塞,将稀硫酸快速加入B中后,关闭活塞.
⑥挤压空气气囊,持续约1分钟.
⑦称量并记录装置D的质量(m2).(称量时注意封闭此装置)
⑧计算.
请填空回答下列问题:
(1)装置A的作用是
(2)若所取Na2CO3样品的质量为5.3g,为确保实验顺利完成,分液漏斗F中至少要盛放10%的稀硫酸(密度为1.07g/mL)