摘要:有人设计了如图所示实验装置.目的是做钠与水反应实验.并验证①钠的物理性质,②钠与水反应的产物是什么. ⑴当进行适当操作时还需要的仪器有 . ⑵如何进行操作? . ⑶实验现象是 .19.下图为配制0.2mol·L-1Na2CO3溶液250mL示意图. 回答下列问题: (1)①中称得Na2CO3 g. (2)玻璃棒在②.③两步中的作用分别是 . . (3)若出现如下情况.对所配溶液浓度有何影响?(填“偏高 .“偏低 或“无影响 ) A.某同学在第⑧步观察液面时俯视 , B.没有进行操作步骤④和⑤ , C.在第⑤步不慎有少量液体流到容量瓶外 .
网址:http://m.1010jiajiao.com/timu3_id_199465[举报]
 某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表.
某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表.| 实验方案 | 实验现象 |
| 1用砂纸擦后的镁带与沸水反应,再向反应后溶液中滴加酚酞 | A浮于水面,熔成一个小球,在水面上无定向移动,随之消失,溶液变红色 |
| 2向新制的H2S饱和溶液中滴加新制的氯水 | B产生气体,可在空气中燃烧,溶液变成浅红色 |
| 3钠与滴有酚酞试液的冷水反应 | C反应不十分强烈,产生的气体可以在空气中燃烧 |
| 4镁带与2mol?L-1的盐酸反应 | D剧烈反应,产生可燃性气体 |
| 5铝条与2mol?L-1的盐酸反应 | E生成白色胶状沉淀,既而沉淀消失 |
| 6向AlCl3溶液滴加NaOH溶液至过量 | F生成淡黄色沉淀 |
(1)实验目的:
(2)实验用品:仪器:①
⑦玻璃片⑧砂纸等;
药品:钠、镁带、铝条、2mol?L-1的盐酸、新制的氯水、饱和的H2S溶液、AlCl3溶液、NaOH溶液等.
(3)实验内容:(填写与实验方案相对应的实验现象)
1
写出③的离子方程式
(4)实验结论:
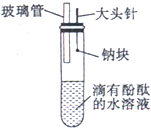
(5)有人设计了如图所示的钠与水反应实验装置,并验证钠的物理性质,钠与水反应产物.
Ⅰ.当进行适当操作时还需要的仪器有
Ⅱ.如何进行操作?
Ⅲ.实验现象是
 为了确定CH3COOH、
为了确定CH3COOH、 及H2CO3的酸性强弱,有人设计了如图所示的装置进行实验:
及H2CO3的酸性强弱,有人设计了如图所示的装置进行实验:(1)若锥形瓶中装有一种易溶于水的正盐固体,则A中发生反应的离子方程式
(2)装置B中盛放的试剂是
(3)实中观察到C中出现的主要现象是
 为了确定HCl、C6H5OH及H2CO3的酸性强弱,有人设计了如图所示的装置进行实验:
为了确定HCl、C6H5OH及H2CO3的酸性强弱,有人设计了如图所示的装置进行实验:(1)若锥形瓶中装有适量易溶于水的正盐固体,则A中发生反应的离子方程式为:
CO32-+2H+=CO2↑+H2O
CO32-+2H+=CO2↑+H2O
.(2)装置B中盛放的试剂是
饱和的碳酸氢钠溶液
饱和的碳酸氢钠溶液
,它的作用是吸收氯化氢
吸收氯化氢
.(3)装置C中盛放的试剂是
苯酚钠溶液
苯酚钠溶液
,实验中观察到C中出现的主要现象是溶液变浑浊
溶液变浑浊
,发生反应的方程式是C6H5ONa+H2O+CO2→C6H5OH+NaHCO3
C6H5ONa+H2O+CO2→C6H5OH+NaHCO3
.某铝合金(硬铝)中含有铝、镁、铜、硅,为了测定该合金中铝的含量,有人设计了如图所示实验:(已知:硅不与盐酸和水反应)

(1)若固体Ⅰ中含有铜和硅,步骤①的试剂X应选择
(2)固体Ⅲ的化学式为
(3)该铝合金中铝的质量分数是
%
%.
(4)步骤④中的沉淀没有用蒸馏水洗涤时,会使测定结果
查看习题详情和答案>>

(1)若固体Ⅰ中含有铜和硅,步骤①的试剂X应选择
盐酸
盐酸
(填“NaOH溶液”“盐酸”“FeCl3溶液”);步骤②的操作是过滤
过滤
,得到固体Ⅱ反应的离子方程式为Mg2++2OH-=Mg(OH)2↓
Mg2++2OH-=Mg(OH)2↓
.(2)固体Ⅲ的化学式为
Al2O3
Al2O3
;步骤④反应的化学方程式为2Al(OH)3↓
Al2O3+3H2O
| ||
2Al(OH)3↓
Al2O3+3H2O
.
| ||
(3)该铝合金中铝的质量分数是
| 900b |
| 17a |
| 900b |
| 17a |
(4)步骤④中的沉淀没有用蒸馏水洗涤时,会使测定结果
偏高
偏高
(填“偏高”“偏低”“不影响”). 为了确定醋酸溶液、二氧化碳水溶液、苯酚溶液的酸性强弱,有人设计了如图所示的装置进行实验:
为了确定醋酸溶液、二氧化碳水溶液、苯酚溶液的酸性强弱,有人设计了如图所示的装置进行实验: