摘要:13.放出,46kJ 解析:1mol H2中有1molH-H键.1molN2中有1mol N≡N.1molNH3中有3molN-H键.根据化学方程式N2+3H22NH3.要生成2molNH3.需要断裂1mol N≡N.3molH-H键.总共吸收热量:946k J+436kJ×3=2254kJ,同时要形成6molN-H键.总共放出热量:391k J×6=2346k J.吸收的热量小于放出的热量.所以该反应是一个放出热量的反应.两者之间的差值为:2346k J-2254kJ=92kJ.即每生成1molNH3放出热量92kJ×1/2=46kJ.
网址:http://m.1010jiajiao.com/timu3_id_198947[举报]
(1)已知含11.2g KOH的稀溶液与1L0.1mol?L-1的H2SO4稀溶液反应放出11.46KJ的热量.请写出KOH的稀溶液与的H2SO4稀溶液发生中和反应,表示中和热的热化学方程式为
(2)在相同条件下,下列两个反应的反应热分别为△H1和△H2表示:
①2H2 (g)+O2(g)=2H2O(g)△H1,
②2H2 (g)+O2(g)=2H2O(l)△H2,则△H1和△H2的关系为
查看习题详情和答案>>
KOH(aq)+
H2SO4(aq)=
K2SO4(aq)+H2O△H=-56.3kJ/mol
| 1 |
| 2 |
| 1 |
| 2 |
KOH(aq)+
H2SO4(aq)=
K2SO4(aq)+H2O△H=-56.3kJ/mol
| 1 |
| 2 |
| 1 |
| 2 |
(2)在相同条件下,下列两个反应的反应热分别为△H1和△H2表示:
①2H2 (g)+O2(g)=2H2O(g)△H1,
②2H2 (g)+O2(g)=2H2O(l)△H2,则△H1和△H2的关系为
△H1>△H2
△H1>△H2
.某化学小组模拟工业生产制取HNO3,设计如图所示装置,其中a为一个可持续鼓入空气的橡皮球.
请回答下列问题:
(1)写出装置A中主要反应的化学方程式
(2)已知1molNO2与液态水反应生成HNO3溶液和NO气体放出热量46kJ,写出该反应的热化学方程式
该反应是一个可逆反应,欲要提高NO2的转化率,可采取的措施是
A.降低温度 B.升高温度 C.减小压强 D.增大压强
(3)实验结束后,关闭止水夹b、c,将装置D,浸入冰水中,现象是
查看习题详情和答案>>

请回答下列问题:
(1)写出装置A中主要反应的化学方程式
2NH4Cl+Ca(OH)2
2NH3↑+CaCl2+2H2O
| ||
2NH4Cl+Ca(OH)2
2NH3↑+CaCl2+2H2O
.
| ||
(2)已知1molNO2与液态水反应生成HNO3溶液和NO气体放出热量46kJ,写出该反应的热化学方程式
3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)△H=-138kJ?mol-1
3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)△H=-138kJ?mol-1
;该反应是一个可逆反应,欲要提高NO2的转化率,可采取的措施是
BC
BC
A.降低温度 B.升高温度 C.减小压强 D.增大压强
(3)实验结束后,关闭止水夹b、c,将装置D,浸入冰水中,现象是
颜色变浅
颜色变浅
.已知:N2(g)+3H2(g)?2NH3(g)△H=-92KJ/mol,一定条件下,将3molN2和3molH2充入2L密闭容器中反应,2分钟达到平衡状态,放出热量46KJ.计算:
(1)用NH3的浓度变化表示2分钟内的反应速率;
(2)反应开始时与平衡状态下容器中的压强之比.(写出计算过程)
查看习题详情和答案>>
(1)用NH3的浓度变化表示2分钟内的反应速率;
0.25mol/(L?min)
0.25mol/(L?min)
.(2)反应开始时与平衡状态下容器中的压强之比.(写出计算过程)
N2(g)+3H2(g)?2NH3(g)△n
1mol (3+1-2)=2mol
0.5mol 0.5mol×2=1mol
根据以上计算可知,3molN2和3molH2充入2L密闭容器中反应,反应后气体的物质的量减少了1mol,反应后气体的物质的量为:3mol+3mol-1mol=5mol,
密闭容器中,压强之比等于气体总物质的量之比,反应开始时与平衡状态下容器中的压强之比为:(3mol+3mol):5mol=6:5
1mol (3+1-2)=2mol
0.5mol 0.5mol×2=1mol
根据以上计算可知,3molN2和3molH2充入2L密闭容器中反应,反应后气体的物质的量减少了1mol,反应后气体的物质的量为:3mol+3mol-1mol=5mol,
密闭容器中,压强之比等于气体总物质的量之比,反应开始时与平衡状态下容器中的压强之比为:(3mol+3mol):5mol=6:5
N2(g)+3H2(g)?2NH3(g)△n
1mol (3+1-2)=2mol
0.5mol 0.5mol×2=1mol
根据以上计算可知,3molN2和3molH2充入2L密闭容器中反应,反应后气体的物质的量减少了1mol,反应后气体的物质的量为:3mol+3mol-1mol=5mol,
密闭容器中,压强之比等于气体总物质的量之比,反应开始时与平衡状态下容器中的压强之比为:(3mol+3mol):5mol=6:5
.1mol (3+1-2)=2mol
0.5mol 0.5mol×2=1mol
根据以上计算可知,3molN2和3molH2充入2L密闭容器中反应,反应后气体的物质的量减少了1mol,反应后气体的物质的量为:3mol+3mol-1mol=5mol,
密闭容器中,压强之比等于气体总物质的量之比,反应开始时与平衡状态下容器中的压强之比为:(3mol+3mol):5mol=6:5
(2007?淄博三模)某化学小组模拟工业生产制取HNO3,设计如图1所示装置,其中a为一个可持续鼓入空气的橡皮球.请回答下列问题:
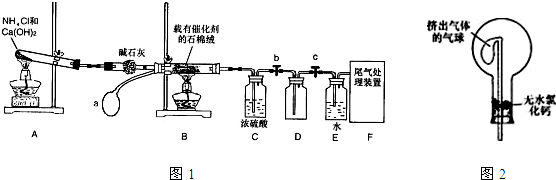
(1)写出装置A中主要反应的化学方程式
(2)已知1mol NO2与液态水反应生成HNO3溶液和NO气体放出热量46kJ,写出该反应的热化学方程式
该反应是一个可逆反应,欲要提高NO2的转化率,可采取的措施是
A.降低温度 B.升高温度 C.减小压强 D.增大压强
(3)实验结束后,关闭止水夹b、c,将装置D,浸入冰水中,现象是
(4)装置C中浓H2SO4的作用是
(5)请你帮助该化学小组设计实验室制取NH3的另一方案
(6)干燥管中的碱石灰用于干燥NH3,某同学思考是否可用无水氯化钙代替碱石灰,并设计如图2所示装置(仪器固定装置省略未画)进行验证.实验步骤如下:
①用烧瓶收集满干燥的氨气,立即塞上如图所示的橡胶塞.
②正立烧瓶,使无水氯化钙固体滑入烧瓶底部,摇动,可以观察到的现象是
查看习题详情和答案>>

(1)写出装置A中主要反应的化学方程式
2NH4Cl+Ca(OH)2
2NH3↑+CaCl2+2H2O
| ||
2NH4Cl+Ca(OH)2
2NH3↑+CaCl2+2H2O
.
| ||
(2)已知1mol NO2与液态水反应生成HNO3溶液和NO气体放出热量46kJ,写出该反应的热化学方程式
3NO2(g)+H2O(l)═2HNO3(aq)+NO(g)△H=-138kJ?mol-1
3NO2(g)+H2O(l)═2HNO3(aq)+NO(g)△H=-138kJ?mol-1
.该反应是一个可逆反应,欲要提高NO2的转化率,可采取的措施是
AD
AD
.A.降低温度 B.升高温度 C.减小压强 D.增大压强
(3)实验结束后,关闭止水夹b、c,将装置D,浸入冰水中,现象是
颜色变浅
颜色变浅
.(4)装置C中浓H2SO4的作用是
吸收多余的NH3
吸收多余的NH3
.(5)请你帮助该化学小组设计实验室制取NH3的另一方案
加热浓氨水制取NH3
加热浓氨水制取NH3
.(6)干燥管中的碱石灰用于干燥NH3,某同学思考是否可用无水氯化钙代替碱石灰,并设计如图2所示装置(仪器固定装置省略未画)进行验证.实验步骤如下:
①用烧瓶收集满干燥的氨气,立即塞上如图所示的橡胶塞.
②正立烧瓶,使无水氯化钙固体滑入烧瓶底部,摇动,可以观察到的现象是
气球膨胀
气球膨胀
,由此,该同学得出结论:不能用CaCl2代替碱石灰.