摘要: (1)Zn - 2e- == 2 mol/L
网址:http://m.1010jiajiao.com/timu3_id_198374[举报]
在银锌原电池中,以硫酸铜为电解质溶液,锌为
查看习题详情和答案>>
负
负
极,电极上发生的是氧化
氧化
反应(“氧化”或“还原”),电极反应式为Zn-2e-═Zn2+
Zn-2e-═Zn2+
,锌片上观察到的现象为锌逐渐溶解
锌逐渐溶解
.银为正
正
极,电极上发生的是还原
还原
反应(“氧化”或“还原”),电极反应式是Cu2++2e-═Cu
Cu2++2e-═Cu
,银片上观察到的现象是有红色物质析出
有红色物质析出
.下列烧杯中盛放的都是稀硫酸其中:
(1)能形成原电池的装置是
(3)正极电极反应式是
查看习题详情和答案>>
(1)能形成原电池的装置是
A
A
; (2)该原电池的正极是Cu
Cu
(3)正极电极反应式是
2H++2e-=H2↑
2H++2e-=H2↑
;(4)负极是Zn
Zn
;(5)负极电极反应式是Zn-2e-=Zn2+
Zn-2e-=Zn2+
.
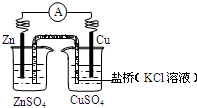 铜锌原电池(如图)工作时,下列叙述正确的是( )
铜锌原电池(如图)工作时,下列叙述正确的是( )| A、外电路中,电子从锌棒经导线流向铜棒 | B、电池总反应为:Zn+2H+?Zn2++H2↑ | C、正极反应为:Zn-2e-?Zn2+ | D、盐桥中的K+移向ZnSO4溶液 |
 关于如图所示装置的叙述,正确的是( )
关于如图所示装置的叙述,正确的是( ) 对于锌、铜和稀硫酸组成的原电池(如图),下列有关说法不正确的是( )
对于锌、铜和稀硫酸组成的原电池(如图),下列有关说法不正确的是( )