题目内容
 关于如图所示装置的叙述,正确的是( )
关于如图所示装置的叙述,正确的是( )| A、铜片为正极,铜片上有无色气泡产生 | B、铜片质量逐渐减少 | C、锌片为负极,电极反应为Zn-2e-?Zn2+ | D、溶液的pH将逐渐增大 |
分析:锌比铜活泼,锌为负极,被氧化,发生Zn-2e-═Zn2+,铜为正极,正极上通入空气发生O2+2H2O+4e-═4OH-,以此解答该题.
解答:解:锌比铜活泼,锌为负极,被氧化,发生Zn-2e-═Zn2+,铜为正极,正极上通入空气发生O2+2H2O+4e-═4OH-,为锌的吸氧腐蚀,溶液生成OH-,与Zn2+反应生成Zn(OH)2,难溶于水,溶液pH基本不变,
故选:C.
故选:C.
点评:本题考查原电池知识,侧重于电极反应的书写和判断,注意把握原电池的工作原理和电极反应式的书写,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
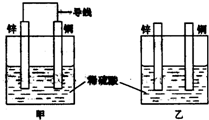 关于如图所示装置的叙述,正确的是( )
关于如图所示装置的叙述,正确的是( )| A、两装置中锌片都发生氧化反应 | B、两装置中溶液的pH均增大 | C、两装置中铜片的质量均逐渐减小 | D、两装置中铜片表面均无气泡产生 |

 关于如图所示装置的叙述正确的是( )
关于如图所示装置的叙述正确的是( )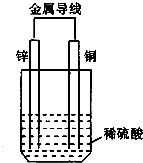
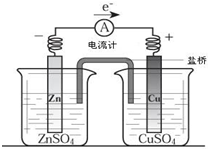 关于如图所示装置的叙述,正确的是( )
关于如图所示装置的叙述,正确的是( )