网址:http://m.1010jiajiao.com/timu3_id_198158[举报]
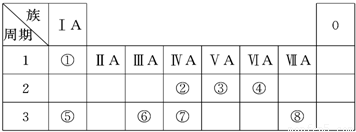
(1)地壳中含量居于第二位的元素在周期表中的位置是______.
(2)②、⑦的最高价含氧酸的酸性是由强到弱的,用原子结构解释原因:______,原子半径逐渐增大,得电子能力逐渐减弱,非金属性逐渐减弱.
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含共价键的离子化合物,写出其中一种化合物的电子式______.
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,下列物质不能做该反应催化剂的是(填序号)______.
a.MnO2 b.CuSO4 c.Na2SO3 d.FeCl3
(5)W与④是相邻的同主族元素.在下表中列出H2WO3的各种不同化学性质,举例并写出相应的化学方程式.
| 编号 | 性质 | 化学方程式 |
| 示例 | 氧化性 | H2WO3+3H3PO3═3H3PO4+H2W↑ |
| 1 | ______ | ______ |
| 2 | ______ | ______ |
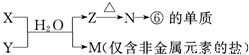
X溶液与Y溶液反应的离子方程式______,
N→⑥的单质的化学方程式为______冰晶石4Al+3O2↑ 查看习题详情和答案>>
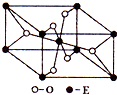 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B二种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B二种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.请回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)E的基态原子的外围电子排布式为
(2)下列叙述正确的是
a.M与水分子间能形成氢键,N是非极性分子
b.M和二氧化碳分子中的中心原子均采用sp2杂化
c.N分子中含有6个σ键和1个π键
d.BD2晶体的熔点、沸点都比二氧化硅晶体的低
(3)E的一种氧化物Q,其晶胞结构如右上图所示,则Q的化学式为
(4)电镀厂排放的废水中常含有剧毒的BC-离子,可在Q的催化下,先用NaClO将BC-氧化成BCD-,再在酸性条件下BCD-继续被NaClO氧化成C2和BD2.
①A、B、C、D四种元素的电负性由小到大的顺序为
②与BCD-互为等电子体的分子、离子的化学式依次为
③上述反应中后一步反应的离子方程式是
(5)在浓的ECl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为ECl3?6H20的绿色晶体,该晶体中两舞更体的物质的量之比为1:5,则该配离子的化学式为
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期。A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍。A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B二种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂。E有“生物金属”之称,E![]() 离子和氩原子的核外电子排布相同。
离子和氩原子的核外电子排布相同。
请回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)E的基态原子的外围电子排布式为 。
 (2)下列叙述正确的是 。(填字母)
(2)下列叙述正确的是 。(填字母)
a.M与水分子间能形成氢键,N是非极性分子
b.M和二氧化碳分子中的中心原子均采用sp2杂化
c.N分子中含有6个![]() 键和1个
键和1个![]() 键
键
d.BD2晶体的熔点、沸点都比二氧化硅晶体的低
(3)E的一种氧化物Q,其晶胞结构如右上图所示,则Q的化学式为 ,该晶体中氧的配位数为 。
(4)电镀厂排放的废水中常含有剧毒的BC![]() 离子,可在Q的催化下,先用NaClO将 BC
离子,可在Q的催化下,先用NaClO将 BC![]() 氧化成BCD
氧化成BCD![]() ,再在酸性条件下BCD
,再在酸性条件下BCD![]() 继续被NaClO氧化成C2和BD2。
继续被NaClO氧化成C2和BD2。
① A、B、C、D四种元素的电负性由小到大的顺序为 。
② 与BCD![]() 互为等电子体的分子、离子的化学式依次为 (各写1种)。
互为等电子体的分子、离子的化学式依次为 (各写1种)。
③ 上述反应中后一步反应的离子方程式是 。
(5)在浓的ECl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为ECl3?6H20的绿色晶体,该晶体中两舞更体的物质的量之比为1:5,则该配离子的化学式为 。
查看习题详情和答案>> 短周期元素A、B、C、D原子序数依次增大,且C元素最高价氧化物对应的水化物,能电离出电子数相等的阴、阳离子.A、C位于同一主族,A为非金属元素,B的最外层电子数是次外层的3倍,B、C的最外层电子数之和与D的最外层电子数相等.E单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏.
短周期元素A、B、C、D原子序数依次增大,且C元素最高价氧化物对应的水化物,能电离出电子数相等的阴、阳离子.A、C位于同一主族,A为非金属元素,B的最外层电子数是次外层的3倍,B、C的最外层电子数之和与D的最外层电子数相等.E单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏.请回答下列问题:
(1)C的最高价氧化物对应水化物电子式为
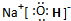
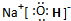
(2)由上述A、B、C、D四种元素中的三种组成某种盐,水溶液显碱性,是家用消毒剂的主要成分.将该盐溶液滴入KI淀粉溶液中,溶液变为蓝色,则反应的离子方程式为
(3)用石墨电极电解CD的饱和溶液,若反应后溶液的体积为200mL,测得pH为13,则阳极得到的气体的物质的量为
(4)E元素与D元素可形成ED2和ED3两种化合物,下列说法正确的是(填序号)
①保存ED2溶液时,需向溶液中加入少量E单质
②ED2只能通过置换反应生成,ED3只能通过化合反应生成
③铜片、碳棒和ED3溶液组成原电池,电子由铜片沿导线流向碳棒④向淀粉碘化钾溶液和苯酚溶液中分别滴加几滴ED3的浓溶液,原无色溶液都变成紫色
(5)25℃时,将pH=4.00的A元素与D元素形成化合物AD的水溶液稀释1.00×103倍,则稀释后溶液中各离子浓度必遵循的定量等式关系式是
(6)将一定量的D单质通入一定浓度的苛性钾溶液,两者恰好完全反应(已知反应过程放热),生成物中有三种含D元素的离子,其中两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.该苛性钾溶液中KOH的质量是
⑴A、C、D形成的化合物中含有的化学键类型为 。
⑵已知:
① E-E→2E ?H=+a kJ/mol;
② 2A→A-A ?H=-b kJ/mol;
③ E+A→A-E ?H=-c kJ/mol;
写出298K时,A2与E2反应的热化学方程式 。
⑶在某温度下容积均为2 L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2A2(g)+BC(g)
 X(g) ?H=-Q kJ/mol(Q>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
X(g) ?H=-Q kJ/mol(Q>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:| 实验 | 甲 | 乙 | 丙 |
| 初始投料 | 2 mol A2、1 mol BC | 1 mol X | 4 mol A2、2 mol BC |
| 平衡时n(X) | 0.5 mol | n2 | n3 |
| 反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 体系的压强 | P1 | P2 | P3 |
| 反应物的转化率 |  1 1 |  2 2 |  3 3 |
v (A2)= 。
② 计算该温度下此反应的平衡常数K = 。
③三个容器中的反应分别达平衡时下列各组数据关系正确的是 (填字母)。
A.α1+α2=1 B.Q1+Q2=Q C.α3<α1
D.P3<2P1=2P2 E.n2<n3<1.0 mol F.Q3=2Q1
④在其他条件不变的情况下,将甲容器的体积压缩到1 L,若在第8min达到新的平衡时A2的总转化率为75%,请在下图中画出第5min 到新平衡时X的物质的量浓度的变化曲线。

⑷熔融碳酸盐燃料电池(MCFC)是一种高温燃料电池,被称为第二代燃料电池,是未来民用发电的理想选择方案之一,其工作原理如图所示。现以A2(g)、BC(g)为燃料,以一定比例Li2CO3和Na2CO3低熔混合物为电解质。写出该碳酸盐燃料电池(MCFC)正极的电极反应式____________________________。
