网址:http://m.1010jiajiao.com/timu3_id_197346[举报]
常温下,在密闭容器中分别充入两种气体各0.1mol,在一定条件下充分反应后,恢复到原温度时,压强降低为开始的 ,则原混合气体可能是
,则原混合气体可能是
[ ]
(1)判断反应达到平衡状态的依据是
a. 生成CH3OH的速率与消耗CO的速率相等
b. 混合气体的密度不变
c. 混合气体的相对平均分子质量不变
d. CH3OH、CO、H2的浓度都不再发生变化
(2)下表所列数据是反应在不同温度下的化学平衡常数(K).
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②要提高CO的转化率,可以采取的措施是
a.升温 b.加入催化剂 c.增加CO的浓度
d.加入H2加压 e.加入惰性气体加压 f.分离出甲醇
③某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应10min后,达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为
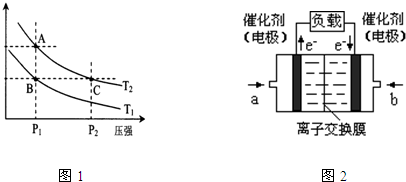
(3)图1表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A
(4)一定条件下,0.5mol甲醇蒸气完全燃烧生成二氧化碳气体和液态水,放出QKJ的热量.写出该反应的热化学方程式
| 容器 | 物质 | 起始浓度/(mol?L-1) | 平衡浓度/(mol?L-1) |
| Ⅰ | N2O4 | 0.100 | 0.040 |
| NO2 | 0 | 0.120 | |
| Ⅱ | N2O4 | 0 | 0.014 |
| NO2 | 0.100 | 0.072 |
| A、平衡时,Ⅰ、Ⅱ中反应物的转化率α(N2O4)<α(NO2) |
| B、平衡时,Ⅰ、Ⅱ中上述正反应的平衡常数K(Ⅰ)=2K(Ⅱ) |
| C、平衡后,升高相同温度,以N2O4表示的反应速率ν(Ⅰ)<ν(Ⅱ) |
| D、平衡后,升高温度,Ⅰ、Ⅱ中气体颜色都将变深 |
工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:
CO(g) + 2H2(g) ![]() CH3OH(g) Δ H
CH3OH(g) Δ H
(1)判断反应达到平衡状态的依据是 (填序号)。
a. 生成CH3OH的速率与消耗CO的速率相等
b. 混合气体的密度不变 c. 混合气体的相对平均分子质量不变
d. CH3OH、CO、H2的浓度都不再发生变化
(2)下表所列数据是反应在不同温度下的化学平衡常数(K)。
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
①由表中数据判断ΔH 0 (填“>”、“=”或“<”)。
②要提高CO的转化率,可以采取的措施是_________(填序号)。
a.升温 b.加入催化剂 c.增加CO的浓度
d.加入H2加压 e.加入惰性气体加压 f.分离出甲醇
③某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应10min后,达到平衡时测得c(CO)= 0.2 mol/L,则CO的转化率为 ,此时的温度为 。以CH3OH表示该过程的反应速率
v(CH3OH)= mol /(L · min)。
(3)图一表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A____C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A_____C,由状态B到状态A,可采用______的方法(填“升温”或“降温”)。

(4)一定条件下,0.5mol甲醇蒸气完全燃烧生成二氧化碳气体和液态水,放出QKJ的热量。写出该反应的热化学方程式 。
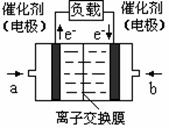
图二是甲醇燃料电池(电解质溶液为KOH溶液)结构示意图,写出 a处电极上发生的电极反应式 。
查看习题详情和答案>>(1)判断反应达到平衡状态的依据是______(填序号).
a. 生成CH3OH的速率与消耗CO的速率相等
b. 混合气体的密度不变
c. 混合气体的相对平均分子质量不变
d. CH3OH、CO、H2的浓度都不再发生变化
(2)下表所列数据是反应在不同温度下的化学平衡常数(K).
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②要提高CO的转化率,可以采取的措施是______(填序号).
a.升温 b.加入催化剂 c.增加CO的浓度
d.加入H2加压 e.加入惰性气体加压 f.分离出甲醇
③某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应10min后,达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为______,此时的温度为______.以CH3OH表示该过程的反应速率v(CH3OH)=______mol/.
(3)图1表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A______C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A______C,由状态B到状态A,可采用______的方法(填“升温”或“降温”).

(4)一定条件下,0.5mol甲醇蒸气完全燃烧生成二氧化碳气体和液态水,放出QKJ的热量.写出该反应的热化学方程式______.图2是甲醇燃料电池(电解质溶液为KOH溶液)结构示意图,写出 a处电极上发生的电极反应式______.
查看习题详情和答案>>