题目内容
在100℃时,将N2O4、NO2分别充入两个各为1L的密闭容器中,反应过程中浓度变化如下:[2NO2(g)?N2O4(g)△H<0]
下列说法正确的是( )
| 容器 | 物质 | 起始浓度/(mol?L-1) | 平衡浓度/(mol?L-1) |
| Ⅰ | N2O4 | 0.100 | 0.040 |
| NO2 | 0 | 0.120 | |
| Ⅱ | N2O4 | 0 | 0.014 |
| NO2 | 0.100 | 0.072 |
| A、平衡时,Ⅰ、Ⅱ中反应物的转化率α(N2O4)<α(NO2) |
| B、平衡时,Ⅰ、Ⅱ中上述正反应的平衡常数K(Ⅰ)=2K(Ⅱ) |
| C、平衡后,升高相同温度,以N2O4表示的反应速率ν(Ⅰ)<ν(Ⅱ) |
| D、平衡后,升高温度,Ⅰ、Ⅱ中气体颜色都将变深 |
分析:根据勒夏特列原理进行判断.升温,加快化学反应速率,平衡向着吸热的方向移动;平衡常数只与温度有关.
解答:解:A.Ⅰ中α(N2O4)=(0.1-0.04)÷0.1=0.6,α(NO2)=(0.1-0.072)÷0.1=0.28,故Ⅰ、Ⅱ中反应物的转化率α(N2O4)>α(NO2),故A错误;
B.平衡常数只与温度有关,温度相同,平衡常数相同,故K(Ⅰ)=K(Ⅱ),故B错误;
C. 由表格数据可知,平衡时c(N2O4),Ⅰ>Ⅱ,故以N2O4表示的反应速率ν(Ⅰ)>ν(Ⅱ),升高相同温度,以N2O4表示的反应速率ν(Ⅰ)>ν(Ⅱ),故C错误;
D.2NO2(g)?N2O4(g)△H<0,升高温度,平衡逆向移动,NO2浓度增大,颜色变深,故D正确,
故选D.
B.平衡常数只与温度有关,温度相同,平衡常数相同,故K(Ⅰ)=K(Ⅱ),故B错误;
C. 由表格数据可知,平衡时c(N2O4),Ⅰ>Ⅱ,故以N2O4表示的反应速率ν(Ⅰ)>ν(Ⅱ),升高相同温度,以N2O4表示的反应速率ν(Ⅰ)>ν(Ⅱ),故C错误;
D.2NO2(g)?N2O4(g)△H<0,升高温度,平衡逆向移动,NO2浓度增大,颜色变深,故D正确,
故选D.
点评:本题考查化学反应速率和化学平衡的因素,难度不大.要注意平衡常数只与温度有关.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
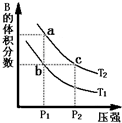 对于反应A(g)?2B(g)△H>0,在温度为T1、T2时,平衡体系中B的体积分数随压强变化的曲线如图所示.回答下列各题.
对于反应A(g)?2B(g)△H>0,在温度为T1、T2时,平衡体系中B的体积分数随压强变化的曲线如图所示.回答下列各题. 氮可形成多种氧化物,如NO、NO2、N2O4等,NO2和N2O4可以相互转化.
氮可形成多种氧化物,如NO、NO2、N2O4等,NO2和N2O4可以相互转化. 在100℃时,将0.4mol的二氧化氮气体充入2L抽真空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
在100℃时,将0.4mol的二氧化氮气体充入2L抽真空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据: N2O4的平衡常数将
N2O4的平衡常数将 N2O4将
N2O4将 在100℃时,将0.40mol二氧化氮气体充入2L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
在100℃时,将0.40mol二氧化氮气体充入2L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
 非金属元素氮有多种氧化物,如NO、NO2、N2O4等.
非金属元素氮有多种氧化物,如NO、NO2、N2O4等.