摘要: 过碳酸钠(Na2CO4)是一种常见的漂白杀菌剂.其水溶液显碱性.能和盐酸发生下列反应: 2Na2CO4 +4HCl== 4NaCl + 2CO2↑+O2 ↑+2H2O ,工业用的过碳酸钠往往含有少量的碳酸钠.为了测定工业用的过碳酸钠的纯度.可以选择利用下列仪器及石蕊试液进行实验.请回答下列问题: (1).取适量过碳酸钠样品与足量的稀盐酸反应.只要测定反应过程中产生的 体积.就可推算出过碳酸钠的纯度. (2).请选取该实验需要的装置.并按正确连接顺序排列 (填字母.仪器中的试剂都是足量的). (3).判定过碳酸钠试样是否完全反应的实验操作方法和现象是 .
网址:http://m.1010jiajiao.com/timu3_id_197183[举报]
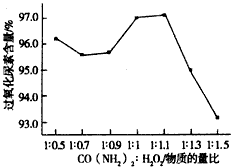
(4)制备反应进行过程中,需要对反应体系不断搅拌,实验中选用玻璃材质的搅拌器,而不是铁质或铝质材料的搅拌器,其原因是____________。
(5)为测定产品中活性氧的含量(活性氧16%,相当于H2O2 34%),称取干燥样品12. 0000 g,溶解,在250 mL容量瓶中定容。准确量取25.00 mL于锥形瓶中,加入1 mL 6 mol/L的硫酸,然后用0.200 0 mol/L
KMnO4标准溶液滴定,至滴入最后一滴时,溶液显浅红色且半分钟内不褪色,三次滴定平均消耗KMnO4
溶液20. 00 mL( KMnO4溶液与尿素不反应)。则产品中活性氧的质量分数为________。
查看习题详情和答案>>
(5)为测定产品中活性氧的含量(活性氧16%,相当于H2O2 34%),称取干燥样品12. 0000 g,溶解,在250 mL容量瓶中定容。准确量取25.00 mL于锥形瓶中,加入1 mL 6 mol/L的硫酸,然后用0.200 0 mol/L
KMnO4标准溶液滴定,至滴入最后一滴时,溶液显浅红色且半分钟内不褪色,三次滴定平均消耗KMnO4
溶液20. 00 mL( KMnO4溶液与尿素不反应)。则产品中活性氧的质量分数为________。
过碳酸钠是一种有多用途的新型氧系固态漂白剂,化学式可表示为Na2CO3?3H2O2,它具有Na2CO3和H2O2的双重性质.过碳酸钠与下列物质均会发生化学反应而失效,其中过碳酸钠只发生了还原反应的是( )
查看习题详情和答案>>
 在一定条件下,A、B、C、D、E、F、G七种物质存在如图所示的转化关系.
在一定条件下,A、B、C、D、E、F、G七种物质存在如图所示的转化关系.已知:B是一种固体单质,焰色反应呈黄色;C是一种常见的无色液体,且跟日常生活密切相关;D是一种淡黄色固体;E是造成温室效应的一种气体;F是一种强碱.请填写:
(1)C的化学式
H2O
H2O
;E的化学式CO2
CO2
;(2)D的名称
过氧化钠
过氧化钠
;(3)A+B→D的化学方程式是
2Na+O2
Na2O2
| ||
2Na+O2
Na2O2
.
| ||
(2010?启东市模拟)过碳酸钠是一种有多用途的新型氧系漂白剂,化学式可表示为aNa2CO3?bH2O2.现将一定质量的过碳酸钠粉末溶于水配成稀溶液,再向其中加入适量MnO2粉末,充分反应后生成672mL气体(标准状况).反应后的混合物经过滤、洗涤后,将滤液和洗涤液混合并加水配成100mL溶液A.现向三份体积为10mL、浓度为cmol/L的稀硫酸中分别逐滴滴入溶液A,边滴边振荡,充分反应后,测得实验数据如下表所示:
(1)计算稀硫酸的物质的量浓度.
(2)通过计算确定过碳酸钠的化学式.
(3)工业上常以所含活性氧的质量分数[w(活性氧)=
×100%]来衡量过碳酸钠产品的优劣,13%以上者为优等品.现将0.2g某厂家生产的过碳酸钠样品(所含杂质不参与后面的氧化还原反应)溶于水配成溶液,加入15.0mL 1mol/L硫酸,再加入足量KI,摇匀后置于暗处,充分反应后,加入少量淀粉试液,用0.1mol/L Na2S2O3溶液滴定到蓝色恰好消失时,共消耗30.00mL,试计算判断该样品是否为优等品.(已知:2Na2S2O3+I2→Na2S4O6+2NaI)
查看习题详情和答案>>
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 滴加溶液A的体积/mL | 10.0 | 20.0 | 30.0 |
| 生成气体的体积/mL(标准状况) | 89.6 | 179.2 | 224 |
(2)通过计算确定过碳酸钠的化学式.
(3)工业上常以所含活性氧的质量分数[w(活性氧)=
| 16n(H2O2) |
| m(样品) |
(2010?济南一模)自2009年3月起,从墨西哥、美国等国逐渐扩散到全世界的甲型H1N1型流感暴发疫情,引起了全球关注和积极应对.防控专家表示,含氯消毒剂和过氧化物等强氧化性消毒剂可防甲型H1N1流感.
(1)过碳酸钠是一种有多用途的新型氧系固态漂白剂,化学式可表示为Na2CO3?3H2O2,它具有Na2CO3和H2O2的双重性质.
①H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称;如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:KCN+H2O2+H2O═A+NH3↑,则生成物A的化学式为
②某强酸性反应体系中,反应物和生成物共六种物质:O2、MnO-4、H2O、Mn2+、H2O2、H+.已知该反应中H2O2只发生了如下过程:H2O2→O2.写出该反应的离子方程式(可不必配平):
(2)漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年.亚氯酸不稳定可分解,反应的离子方程式为:HClO2→ClO2↑+H++Cl-+H2O(未配平).在该反应中,当有1molClO2生成时转移的电子个数是
查看习题详情和答案>>
(1)过碳酸钠是一种有多用途的新型氧系固态漂白剂,化学式可表示为Na2CO3?3H2O2,它具有Na2CO3和H2O2的双重性质.
①H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称;如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:KCN+H2O2+H2O═A+NH3↑,则生成物A的化学式为
KHCO3
KHCO3
,H2O2被称为“绿色氧化剂”的理由是H2O2是氧化剂,其产物是H2O,H2O没有污染性
H2O2是氧化剂,其产物是H2O,H2O没有污染性
.②某强酸性反应体系中,反应物和生成物共六种物质:O2、MnO-4、H2O、Mn2+、H2O2、H+.已知该反应中H2O2只发生了如下过程:H2O2→O2.写出该反应的离子方程式(可不必配平):
2MnO-4+5H2O2+6H+=2Mn2++8H2O+5O2↑
2MnO-4+5H2O2+6H+=2Mn2++8H2O+5O2↑
.(2)漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年.亚氯酸不稳定可分解,反应的离子方程式为:HClO2→ClO2↑+H++Cl-+H2O(未配平).在该反应中,当有1molClO2生成时转移的电子个数是
NA
NA
.