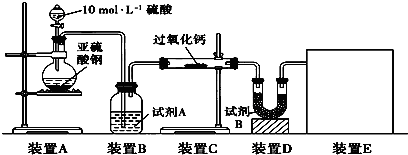
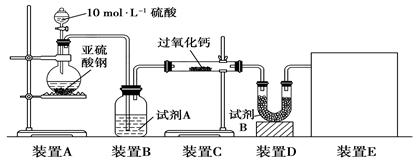
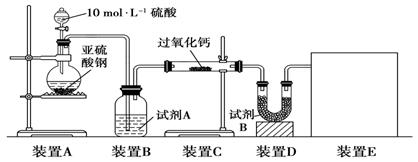
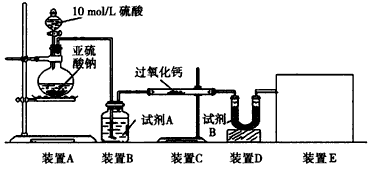
题目内容
过氧化物在日常生活与工农业生产中应用广泛。如:过氧化氢是一种常见的绿色氧化剂,过氧碳酸钠、过氧化尿素则是多功能、高效、广谱的固体消毒剂。
资料显示:过氧化氢是一种无色液体,属于二元弱酸,能与水、乙醇、乙醚以任意比混溶,易分解,且重金属离子 对其分解过程具有促进催化作用。
(1)写出过氧化氢在Fe3+存在条件下分解的化学反应方程式:____________________;过氧化氢可作为绿
色氧化剂的理由是_______________。
(2)某同学为验证H2O2具有弱酸性,在滴加有酚酞的NaOH稀溶液中,加入适量的H2O2,结果发现溶液的红色褪去。你认为能否通过该实验证明H2O2具有酸性,并说明理由________________。如何通过实验进一步证明褪色的真正原因?请写出具体的实验方法:________________。
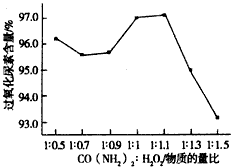
(3)过氧化尿素是一种新型的氧化剂与消毒剂,由H2O2与尿素在30℃反应制得。如图是30℃时过氧化尿素合成过程中原料的物质的量配比对产品含量的影响;你认为实际生产中应将n(H2O2):n[CO(NH2)2]控制在
____________,出现这一实验结果的主要原因是___________________。
(4)制备反应进行过程中,需要对反应体系不断搅拌,实验中选用玻璃材质的搅拌器,而不是铁质或铝质材料的搅拌器,其原因是____________。
(5)为测定产品中活性氧的含量(活性氧16%,相当于H2O2 34%),称取干燥样品12. 0000 g,溶解,在250 mL容量瓶中定容。准确量取25.00 mL于锥形瓶中,加入1 mL 6 mol/L的硫酸,然后用0.200 0 mol/L
KMnO4标准溶液滴定,至滴入最后一滴时,溶液显浅红色且半分钟内不褪色,三次滴定平均消耗KMnO4
溶液20. 00 mL( KMnO4溶液与尿素不反应)。则产品中活性氧的质量分数为________。
(5)为测定产品中活性氧的含量(活性氧16%,相当于H2O2 34%),称取干燥样品12. 0000 g,溶解,在250 mL容量瓶中定容。准确量取25.00 mL于锥形瓶中,加入1 mL 6 mol/L的硫酸,然后用0.200 0 mol/L
KMnO4标准溶液滴定,至滴入最后一滴时,溶液显浅红色且半分钟内不褪色,三次滴定平均消耗KMnO4
溶液20. 00 mL( KMnO4溶液与尿素不反应)。则产品中活性氧的质量分数为________。
(1)2H2O2=2H2O+O2↑;过氧化氢的还原产物是水,加入过氧化氢后不会引入新的杂质
(2)不能,由于H2O2具有强氧化性,可能是H2O2氧化了酚酞而使溶液褪色;向已褪色的溶液中继续加入氢 氧化钠溶液,若溶液又呈现红色,说明褪色是由H2O2的酸性所致,若仍为无色,则说明褪色是由H2O2的强氧化性所致
(3)1.1:1;H2O2在实验过程中会有部分分解,增大H2O2的量可提高过氧化尿素的产量与纯度
(4)过氧化氢能氧化铁、铝,生成的金属离子能催化过氧化氢的分解,影响产率
(5)13.3%
(2)不能,由于H2O2具有强氧化性,可能是H2O2氧化了酚酞而使溶液褪色;向已褪色的溶液中继续加入氢 氧化钠溶液,若溶液又呈现红色,说明褪色是由H2O2的酸性所致,若仍为无色,则说明褪色是由H2O2的强氧化性所致
(3)1.1:1;H2O2在实验过程中会有部分分解,增大H2O2的量可提高过氧化尿素的产量与纯度
(4)过氧化氢能氧化铁、铝,生成的金属离子能催化过氧化氢的分解,影响产率
(5)13.3%

练习册系列答案
相关题目