题目内容
有A、B、C、D、E、F六种元素.A是宇宙中最丰富的元素;B是周期表中电负性数值最大的元素;C的基态原子中2p轨道有三个未成对的单电子;F原子核外电子数是B与C核外电子数之和;D是主族元素,且与副族元素E同周期;E能分别形成红色(或砖红色)的E2O和黑色的EO两种氧化物;D与B可形成离子化合物,其晶胞结构如右图1所示.请回答下列问题.
(1)E元素原子基态时的外围电子排布式为
(2)A2F分子中F原子的杂化类型是
(3)CA3极易溶于水,其原因是
(4)从晶胞结构图1中可以看出,D跟B形成的离子化合物的电子式为
 ;该离子化合物晶体的密度为ρ(g?cm-3).,则晶胞的体积是
;该离子化合物晶体的密度为ρ(g?cm-3).,则晶胞的体积是
(只要求列出算式).
(5)BF3和过量NaF作用可生成NaBF4,BF4-的立体构型为
(6)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为

(1)E元素原子基态时的外围电子排布式为
3d104s1
3d104s1
.(2)A2F分子中F原子的杂化类型是
sp3
sp3
,F的气态氧化物FO3分子的键角为60°
60°
.(3)CA3极易溶于水,其原因是
与水分子之间形成氢键,且二者都是极性分子
与水分子之间形成氢键,且二者都是极性分子
,试判断CA3溶于水后,形成CA3?H2O的最合理结构为b
b
(选填字母).(4)从晶胞结构图1中可以看出,D跟B形成的离子化合物的电子式为


| ||
| ρg?cm-3 |
| ||
| ρg?cm-3 |
(5)BF3和过量NaF作用可生成NaBF4,BF4-的立体构型为
正四面体
正四面体
;(6)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为
共价键
共价键
,层间作用力为范德华力
范德华力
.
分析:有A、B、C、D、E、F六种元素,A是宇宙中最丰富的元素,A为氢元素;B是周期表中电负性数值最大的元素,B为氟元素;C的基态原子中2p轨道有三个未成对的单电子,外围电子排布为2s22p3,故C为氮元素;F原子核外电子数是B与C核外电子数之和,核外电子数为9+7=16,故F为硫元素;E能分别形成红色(或砖红色)的E2O和黑色的EO两种氧化物,E为Cu元素,D与B可形成离子化合物,由晶胞结构图1可知,晶胞中D位于顶点与面心上,故晶胞中含有D元素数目为8×
+6×
=4,F原子处于晶胞内部,晶胞含有氟原子数目为8,故为DF2,D为+2价,D是主族元素,且与副族元素E同周期,故D为Ca元素,据此解答.
| 1 |
| 8 |
| 1 |
| 2 |
解答:解:有A、B、C、D、E、F六种元素,A是宇宙中最丰富的元素,A为氢元素;B是周期表中电负性数值最大的元素,B为氟元素;C的基态原子中2p轨道有三个未成对的单电子,外围电子排布为2s22p3,故C为氮元素;F原子核外电子数是B与C核外电子数之和,核外电子数为9+7=16,故F为硫元素;E能分别形成红色(或砖红色)的E2O和黑色的EO两种氧化物,E为Cu元素,D与B可形成离子化合物,由晶胞结构图1可知,晶胞中D位于顶点与面心上,故晶胞中含有D元素数目为8×
+6×
=4,F原子处于晶胞内部,晶胞含有氟原子数目为8,故为DF2,D为+2价,D是主族元素,且与副族元素E同周期,故D为Ca元素,
(1)E是Cu元素,是29号元素,原子基态时的外围电子排布式为3d104s1,故答案为:3d104s1;
(2)A2F分子是H2S,S原子成2个S-H键,含有2对孤对电子对,杂化轨道数目为4,采取sp3杂化,SO3分子中价层电子对=3+
(6-3×2)=3,该分子中不含孤电子对,所以是平面三角形结构,其键角是60°,故答案为:sp3;60°;
(3)NH3中N元素的电负性很强,与水分子之间形成氢键,且二者都是极性分子,故氨气极易溶于水,
NH3?H2O分子中NH3与H2O通过氢键连接,氨水溶液呈碱性,如果氢键为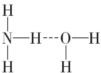 ,N-H键断裂产生NH2-、H3+O,溶液呈酸性;
,N-H键断裂产生NH2-、H3+O,溶液呈酸性;
如果氢键为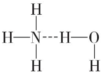 ,O-H断裂产生NH4+、OH-,溶液呈碱性,故为
,O-H断裂产生NH4+、OH-,溶液呈碱性,故为 ,b正确,
,b正确,
故答案为:与水分子之间形成氢键,且二者都是极性分子;b;
(4)由晶胞结构图1可知,晶胞中D位于顶点与面心上,故晶胞中含有D元素数目为8×
+6×
=4,F原子处于晶胞内部,晶胞含有氟原子数目为8,故为CaF2,电子式为 ,晶胞的质量为
,晶胞的质量为
,晶体的密度为ρ(g?cm-3),则晶胞的体积是
,
故答案为: ;
;
;
(5)BF3和过量NaF作用可生成NaBF4,BF4-中B原子的价层电子对=4+
(3+1-4×1)=4,该离子中不含孤电子对,为正四面体结构,故答案为:正四面体;
(6)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为共价键,层间作用力为范德华力,故答案为:共价键;范德华力.
| 1 |
| 8 |
| 1 |
| 2 |
(1)E是Cu元素,是29号元素,原子基态时的外围电子排布式为3d104s1,故答案为:3d104s1;
(2)A2F分子是H2S,S原子成2个S-H键,含有2对孤对电子对,杂化轨道数目为4,采取sp3杂化,SO3分子中价层电子对=3+
| 1 |
| 2 |
(3)NH3中N元素的电负性很强,与水分子之间形成氢键,且二者都是极性分子,故氨气极易溶于水,
NH3?H2O分子中NH3与H2O通过氢键连接,氨水溶液呈碱性,如果氢键为
 ,N-H键断裂产生NH2-、H3+O,溶液呈酸性;
,N-H键断裂产生NH2-、H3+O,溶液呈酸性;如果氢键为
 ,O-H断裂产生NH4+、OH-,溶液呈碱性,故为
,O-H断裂产生NH4+、OH-,溶液呈碱性,故为 ,b正确,
,b正确,故答案为:与水分子之间形成氢键,且二者都是极性分子;b;
(4)由晶胞结构图1可知,晶胞中D位于顶点与面心上,故晶胞中含有D元素数目为8×
| 1 |
| 8 |
| 1 |
| 2 |
 ,晶胞的质量为
,晶胞的质量为| 4×78g/mol |
| 6.02×1023mol-1 |
| ||
| ρg?cm-3 |
故答案为:
 ;
;
| ||
| ρg?cm-3 |
(5)BF3和过量NaF作用可生成NaBF4,BF4-中B原子的价层电子对=4+
| 1 |
| 2 |
(6)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为共价键,层间作用力为范德华力,故答案为:共价键;范德华力.
点评:本题考查结构性质位置关系、核外电子排布规律、分子结构与性质、杂化轨道、化学键与氢键、晶胞的有关计算等,题目综合性较大,难度较大,(3)中氢键的判断为易错点,难点,注意根据氢键的影响导致化学键断裂进行理解.

练习册系列答案
相关题目





