摘要: 30.88%,3.86 mol / L
网址:http://m.1010jiajiao.com/timu3_id_195356[举报]
醇脱水反应在不同温度条件下得到的产物组成不同.下表是常压、某催化剂存在条件下,分别以等量乙醇在不同温度下进行脱水实验获得的数据,每次实验反应时间均相同.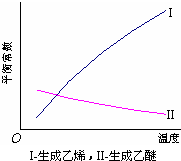
已知:乙醇和乙醚(CH3CH2OCH2CH3)的沸点分别为78.4℃和34.5℃.试回答:
(1)乙醇脱水制乙烯的反应是 (填“放热”、“吸热”)反应,若在上述实验条件下,增大压强,平衡 (选填“正向”、“逆向”、“不”)移动;
(2)写出乙醇脱水制乙醚的反应的平衡常数表达式 .当乙醇起始浓度相同时,平衡常数K值越大,表明 (填序号);
A.乙醇的转化率越高 B.反应进行得越完全
C.达到平衡时乙醇的浓度越大 D.化学反应速率越快
(3)根据表中数据分析,为了又快又多地得到乙醚,反应的合适温度区域是 .选择该温度区域的理由是 .
查看习题详情和答案>>

| 温度 (℃) |
乙醇转化率 (%) |
有机产物含量 (体积分数) | |
| 乙烯(%) | 乙醚(%) | ||
| 115 | 20 | 8.7 | 90.2 |
| 135 | 68 | 16.7 | 82.2 |
| 155 | 88 | 32.3 | 66.8 |
| 175 | 90 | 86.9 | 12.1 |
(1)乙醇脱水制乙烯的反应是
(2)写出乙醇脱水制乙醚的反应的平衡常数表达式
A.乙醇的转化率越高 B.反应进行得越完全
C.达到平衡时乙醇的浓度越大 D.化学反应速率越快
(3)根据表中数据分析,为了又快又多地得到乙醚,反应的合适温度区域是
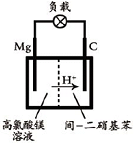 (2012?江苏一模)镁及其合金广泛应用于航空航天、交通、电池等行业,金属镁的制备方法主要有:
(2012?江苏一模)镁及其合金广泛应用于航空航天、交通、电池等行业,金属镁的制备方法主要有:①电解无水氯化镁法,②碳或碳化钙热还原法,③皮江法.
已知:
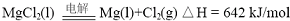
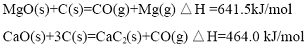
(1)写出MgO(s)与CaC2(s)作用生成Mg(g)及CaO(s)及C(s)的热化学方程式:
CaC2(s)+MgO(s)=CaO(s)+Mg(g)+2C(s),△H=(641.5-464.0)kJ/mol=177.5kJ/mol
CaC2(s)+MgO(s)=CaO(s)+Mg(g)+2C(s),△H=(641.5-464.0)kJ/mol=177.5kJ/mol
.(2)碳化钙还原氧化镁的文献资料如表2
表2 还原剂的用量与温度、保温时间计MgO还原率
| n(CaC2)/N(MgO) | 还原温度/℃ | 恒温时间/h | 还原率/% |
| 1.1 | 1110 | 2.0 | 62 |
| 1.1 | 1150 | 2.0 | 80 |
| 1.1 | 1150 | 2.5 | 85 |
| 1.2 | 1000 | 2.0 | 33 |
| 1.2 | 1150 | 2.0 | 84 |
| 1.2 | 1150 | 2.5 | 88 |
| 1.3 | 1150 | 2.0 | 86 |
| 1.3 | 1150 | 2.0 | 88 |
相同条件下延长保温时间时,还原率增加不明显,生成成本增大
相同条件下延长保温时间时,还原率增加不明显,生成成本增大
;采用n(CaC2)/n(MgO)配比为1.2,而不是1.3,其主要原因是:相同条件下,还原剂配比由1.2升高到1.3,还原剂用量增大,还原率增加不明显,生产成本增大
相同条件下,还原剂配比由1.2升高到1.3,还原剂用量增大,还原率增加不明显,生产成本增大
.(3)用电解法制取镁时,若原料氯化镁含有水时,在电解温度下,原料会形成Mg(OH)Cl,并发生电离反应:Mg(OH)Cl=Mg(OH)++Cl-.电解时在阴极表面会产生氧化镁钝化膜,此时阴极的反应式为
2Mg(OH)++2e-=MgO+H2↑
2Mg(OH)++2e-=MgO+H2↑
.实验室由MgCl2?6H2O制取无水氯化镁可采用的方法是在氯化氢气流中加热脱水
在氯化氢气流中加热脱水
.(4)我国目前生产金属镁主要用皮江法生产,其原料为白云石(MgCO3?CaCO3)的煅烧产物和硅铁(含75%Si).其生产原理为:
2CaO+2MgO(s)+Si(s)
| 1100-1250℃ |
| 真空 |
防止硅和镁被氧化,并提高金属镁的产率
防止硅和镁被氧化,并提高金属镁的产率
.(5)镁/间-二硝基苯电池的装置如图所示,电池工作时镁转变为氢氧化镁,间-二硝基苯则转变为间-二苯胺.该电池正极的电极反应式为


工业以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱.有关反应的化学方程式为:NH3+CO2+H2O=NH4HCO3;
NH4HCO3+NaCl=NaHCO3↓+NH4Cl;2NaHCO3
Na2CO3+CO2↑+H2O
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是
a.碳酸氢钠难溶于水 b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
d.碳酸氢钠的稳定性大于碳酸钠
(2)某活动小组根据上述制碱原理,进行碳酸氢钠的制备实验.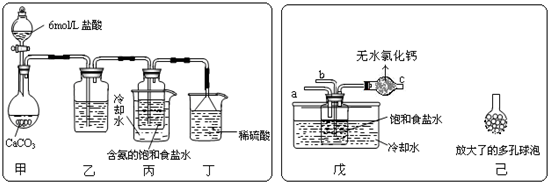
①一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出).
试回答下列有关问题:
(Ⅰ)乙装置中的试剂是
(Ⅱ)丁装置中稀硫酸的作用是
(Ⅲ)实验结束后,分离出NaHCO3 晶体的操作是
②另一位同学用图中戊装置(其它装置未画出)进行实验.
(Ⅰ)实验时,须先从a管通入
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是
(3)碳酸氢钠受热所得固体12.28g与足量的石灰水充分反应,所得沉淀经洗涤、干燥质量为12.00g,则所得固体中碳酸钠的质量分数为
(4)请你再设计出一种实验室制取少量碳酸氢钠的方法:
查看习题详情和答案>>
NH4HCO3+NaCl=NaHCO3↓+NH4Cl;2NaHCO3
| ||
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是
c
c
(填字母标号).a.碳酸氢钠难溶于水 b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
d.碳酸氢钠的稳定性大于碳酸钠
(2)某活动小组根据上述制碱原理,进行碳酸氢钠的制备实验.

①一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出).
试回答下列有关问题:
(Ⅰ)乙装置中的试剂是
饱和碳酸氢钠溶液
饱和碳酸氢钠溶液
,其作用是除去CO2中的HCl气体
除去CO2中的HCl气体
;(Ⅱ)丁装置中稀硫酸的作用是
吸收未反应完的NH3
吸收未反应完的NH3
;(Ⅲ)实验结束后,分离出NaHCO3 晶体的操作是
过滤
过滤
(填分离操作的名称),该操作所需要的玻璃仪器有玻璃棒、漏斗、烧杯
玻璃棒、漏斗、烧杯
.②另一位同学用图中戊装置(其它装置未画出)进行实验.
(Ⅰ)实验时,须先从a管通入
氨气
氨气
气体,说明原因氨气极易溶解于水,能形成较大浓度的溶液,有利于二氧化碳吸收,生成更多的碳酸氢铵
氨气极易溶解于水,能形成较大浓度的溶液,有利于二氧化碳吸收,生成更多的碳酸氢铵
.(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是
增大气体与溶液接触面积,提高CO2的吸收率
增大气体与溶液接触面积,提高CO2的吸收率
.(3)碳酸氢钠受热所得固体12.28g与足量的石灰水充分反应,所得沉淀经洗涤、干燥质量为12.00g,则所得固体中碳酸钠的质量分数为
86.3%
86.3%
.(4)请你再设计出一种实验室制取少量碳酸氢钠的方法:
用碳酸氢铵与适量饱和食盐水反应
用碳酸氢铵与适量饱和食盐水反应
.(2012?重庆)尿素[CO(NH2)2]是首个由无机物人工合成的有机物.
(1)工业上尿素由CO2和NH3在一定条件下合成,其反应方程式为
(2)当氨碳比
=4时,CO2的转化率随时间的变化关系如图1所示.
①A点的逆反应速率v逆(CO2)
②NH3的平衡转化率为
(3)人工肾脏可采用间接电化学方法除去代谢产物中的尿素,原理如图2所示.
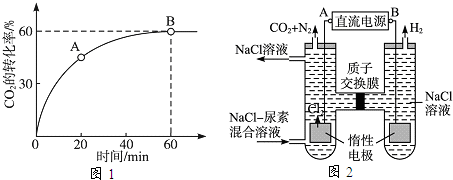
①电源的负极为
②阳极室中发生的反应依次为
③电解结束后,阴极室溶液的pH与电解前相比将
查看习题详情和答案>>
(1)工业上尿素由CO2和NH3在一定条件下合成,其反应方程式为
2NH3+CO2
CO(NH2)2+H2O
| ||
2NH3+CO2
CO(NH2)2+H2O
.
| ||
(2)当氨碳比
| n(NH3) |
| n(CO2) |
①A点的逆反应速率v逆(CO2)
小于
小于
B点的正反应速率v正(CO2)(填“大于”“小于”或“等于”).②NH3的平衡转化率为
30%
30%
.(3)人工肾脏可采用间接电化学方法除去代谢产物中的尿素,原理如图2所示.

①电源的负极为
B
B
(填“A”或“B”).②阳极室中发生的反应依次为
6Cl--6e-═3Cl2↑
6Cl--6e-═3Cl2↑
、CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl
CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl
.③电解结束后,阴极室溶液的pH与电解前相比将
不变
不变
;若两极共收集到气体13.44L(标准状况),则除去的尿素为7.2
7.2
g(忽略气体的溶解).尿素[CO(NH2)2]是首个由无机物人工合成的有机物.
(1)工业上尿素由CO2和NH3在一定条件下合成,其反应方程式为
(2)当氨碳比
=4,时CO2的转化率随时间的变化关系如图1所示.
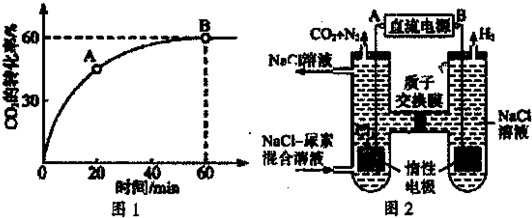
①A点的逆反应速率v逆(CO2)
②反应达到平衡后,NH3的转化率为
(3)人工肾脏可采用间接电化学方法除去代谢产物中的尿素,原理如图2.
①电源的负极为
②阳极室中发生的电极反应为
③电解结束后,阴极室溶液的pH与电解前相比将
查看习题详情和答案>>
(1)工业上尿素由CO2和NH3在一定条件下合成,其反应方程式为
2NH3+CO2
CO(NH2)2+H2O
| 一定条件 |
2NH3+CO2
CO(NH2)2+H2O
.| 一定条件 |
(2)当氨碳比
| n(NH3) |
| n(CO2) |

①A点的逆反应速率v逆(CO2)
小于
小于
B点的正反应速率v正(CO2)(填“<”、“>”或“=”)②反应达到平衡后,NH3的转化率为
30%
30%
.(3)人工肾脏可采用间接电化学方法除去代谢产物中的尿素,原理如图2.
①电源的负极为
B
B
(填“A’或“B”).②阳极室中发生的电极反应为
2Cl--2e-=Cl2↑
2Cl--2e-=Cl2↑
,请用化学方程式描述除去尿素的过程CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl
CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl
.③电解结束后,阴极室溶液的pH与电解前相比将
不变
不变
(填“变大”、“变小”或“不变”);若两极共收集到气体13.44L(标准状况),则除去的尿素为7.2
7.2
g(忽略气体的溶解).