摘要: 熟悉化学键.离子键.共价键等概念的含义.
网址:http://m.1010jiajiao.com/timu3_id_194766[举报]
氮是地球上极为丰富的元素.填写下列空白.
(1)常温下,锂可与氮气直接反应生成Li3N,Li3N晶体中氮以N3-存在,基态N3-的电子排布式为: ,Li3N晶体属于 晶体(填晶体类型).
(2)CO与N2相似,分子中都存在一个共价叁键,CO含 个π键.
(3)根据下表数据,写出氮气与氢气反应生成氨气的热化学方程式. .
(4)氮化硅是一种高温陶瓷材料,它硬度大、熔点高、化学性质稳定.
①氮化硅晶体属于 晶体(填晶体类型);
②已知氮化硅晶体结构中,原子间都以共价键相连,且N原子与N原子,Si原子与Si原子不直接相连,同时每个原子都满足8电子结构,请写出氮化硅的化学式: .
(5)极纯的氮气可由叠氮化钠(NaN3)加热分解而得到.2NaN3(s)=2Na(l)+3N2(g),反应过程中,断裂的化学键是离子键和共价键,形成的化学键有 .
查看习题详情和答案>>
(1)常温下,锂可与氮气直接反应生成Li3N,Li3N晶体中氮以N3-存在,基态N3-的电子排布式为:
(2)CO与N2相似,分子中都存在一个共价叁键,CO含
(3)根据下表数据,写出氮气与氢气反应生成氨气的热化学方程式.
| 化学键 | N-N | N=N | N≡N | N-H | H-H |
| 键能/kJ?mol-1 | 159 | 418 | 946 | 391 | 436 |
①氮化硅晶体属于
②已知氮化硅晶体结构中,原子间都以共价键相连,且N原子与N原子,Si原子与Si原子不直接相连,同时每个原子都满足8电子结构,请写出氮化硅的化学式:
(5)极纯的氮气可由叠氮化钠(NaN3)加热分解而得到.2NaN3(s)=2Na(l)+3N2(g),反应过程中,断裂的化学键是离子键和共价键,形成的化学键有
现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大.室温下E元素的单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜;D元素原子核外M电子层与K电子层上的电子数相等;A可分别与B、F形成A2B,A2B2、AF等共价化合物;C可分别与B、F形成C2B、C2B2、CF等离子化合物.
请回答下列问题:
(1)以上六种元素中,金属性最强的是(填元素符号)
 .
.
(2)以上元素形成的简单离子中,核外电子数相等的是(填真实的离子符号)
(3)C2B2的电子式为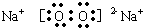
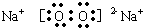 ,该物质中存在的化学键有
,该物质中存在的化学键有
(4)A2B与C2B2反应的化学方程式是
查看习题详情和答案>>
请回答下列问题:
(1)以上六种元素中,金属性最强的是(填元素符号)
Na
Na
,F原子的结构示意图为

(2)以上元素形成的简单离子中,核外电子数相等的是(填真实的离子符号)
O2-、Na+、Mg2+、Al3+
O2-、Na+、Mg2+、Al3+
.(3)C2B2的电子式为
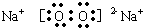
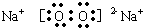
离子键、非极性键(或共价键)
离子键、非极性键(或共价键)
.(4)A2B与C2B2反应的化学方程式是
2H2O+2Na2O2=4NaOH+O2↑
2H2O+2Na2O2=4NaOH+O2↑
. A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图所示.请针对以下不同情况回答:
A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图所示.请针对以下不同情况回答:(1)若A、B、C的焰色反应均呈黄色,水溶液均为碱性.
①A中所含有的化学键是
离子键和共价键
离子键和共价键
.②将4.48L(标准状况下)X通入100mL 3mol/L A的水溶液后,溶液中离子浓度由大到小的顺序为
c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
.③自然界中存在B、C和H2O按一定比例结晶而成的固体.取一定量该固体溶于水配成100mL溶液,测得溶溶中金属阳离子的浓度为0.5mol/L.若取相同质量的固体加热至恒重,剩余固体的质量为
2.65
2.65
.(2)若A为固态非金属单质,A与X同周期,常温常压下C为白色固体,B分子中各原子最外层均为8e-结构.
①下列有关B物质的叙述正确的是
bc
bc
a、B的分子式为AX b、B为共价化合物
c、B分子呈三角锥形 d、B性质稳定,不与除X外的任何物质发生化学反应
②C与水剧烈反应,生成两种常见酸,反应的化学方程式为
PCl5+4H2O=H3PO4+5HC1
PCl5+4H2O=H3PO4+5HC1
.都由短周期元素形成的常见非金属固体单质A与常见金属单质B,在加热条件下反应生成化合物C,C与水反应生成白色沉淀D和气体E,D既能溶于强酸,也能溶于强碱.E在足量空气中燃烧产生刺激性气味气体G,G在大气中能导致酸雨的形成.E被足量氢氧化钠溶液吸收得到无色溶液F,溶液F在空气中长期放置发生反应,生成物之一为H. H与一种相对分子质量为78的供氧剂的结构和化学性质相似,其溶液显黄色.
请回答下列问题:
(1)组成单质A的元素位于周期表中的位置
(2)指出H物质中的化学键类型
(3)写出B与氢氧化钠溶液反应的离子方程式:
(4)E被足量NaOH溶液吸收得到溶液中的离子浓度由大到小关系是
(5)G与氯酸钠在酸性条件下反应可生成消毒杀菌剂二氧化氯.当生成2mol二氧化氯时,转移电子
(6)溶液F在空气中长期放置生成H的化学反应方程式为:
查看习题详情和答案>>
请回答下列问题:
(1)组成单质A的元素位于周期表中的位置
第三周期ⅥA
第三周期ⅥA
.(2)指出H物质中的化学键类型
离子键、共价健
离子键、共价健
.(3)写出B与氢氧化钠溶液反应的离子方程式:
2Al+2OH-+2H2O═2AlO-2+3H2↑
2Al+2OH-+2H2O═2AlO-2+3H2↑
.(4)E被足量NaOH溶液吸收得到溶液中的离子浓度由大到小关系是
C(Na+)>C(S2-)>C(OH-)>C(HS-)>C(H+)
C(Na+)>C(S2-)>C(OH-)>C(HS-)>C(H+)
.(5)G与氯酸钠在酸性条件下反应可生成消毒杀菌剂二氧化氯.当生成2mol二氧化氯时,转移电子
2
2
mol.(6)溶液F在空气中长期放置生成H的化学反应方程式为:
4Na2S+O2+2H2O═4NaOH+2Na2S2(或2Na2S+O2+2H2O═4NaOH+2S,Na2S+S═Na2S2)
4Na2S+O2+2H2O═4NaOH+2Na2S2(或2Na2S+O2+2H2O═4NaOH+2S,Na2S+S═Na2S2)
.下列叙述不正确的是( )
| A、金属与非金属化合时,都能形成离子键 | B、阴、阳离子通过静电引力所形成的化学键叫离子键 | C、离子化合物也可能完全由非金属元素组成的 | D、共价化合物中一定不含有离子键 |