摘要: 已知离子 bX 3+ 的原子结构示意图为: .下列认识正确的是 A.b=10 B.X单质能溶于氢氧化钠溶液 C.X为稀有气体 D.X单质既具有还原性.又具有氧化性
网址:http://m.1010jiajiao.com/timu3_id_194763[举报]
醋酸是日常生活中最常见的调味剂和重要的化工原料,醋酸钠是其常见的盐.(已知:25℃,Ka(CH3COOH)=1.69×10-5). 请回答:
(1)写出醋酸钠在水中发生水解反应的离子方程式:
(2)在CH3COONa溶液中离子浓度由大到小的顺序为
(3)25℃时,醋酸的电离平衡常数表达式Ka=
.0.10mol/L的醋酸溶液的pH约为
(4)对于醋酸溶液和醋酸钠溶液的下列说法正确的是
A.稀释醋酸溶液,醋酸的电离程度增大,而稀释醋酸钠溶液则醋酸钠的水解程度减小.
B.升高温度可以促进醋酸电离,而升高温度则会抑制醋酸钠水解.
C.醋酸和醋酸钠的混合液中,醋酸抑制醋酸钠的水解、醋酸钠也抑制醋酸的电离.
D.醋酸和醋酸钠的混合液中,醋酸促进醋酸钠的水解、醋酸钠也促进醋酸的电离.
(5)物质的量浓度均为0.1mol/L的CH3COONa和CH3COOH溶液等体积混合(注:混合前后溶液体积变化忽略不计),混合液中的下列关系式正确的是
A.c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-)
B.c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
C.c(CH3COO-)+c(CH3COOH)=0.1mol/L
(6)常温时,有以下3种溶液,其中pH最小的是
A.0.02mol?L-1CH3COOH与0.02mol?L-1NaOH溶液等体积混合液
B.0.03mol?L-1CH3COOH与0.01mol?L-1NaOH溶液等体积混合液
C.pH=2的CH3COOH与pH=12的NaOH溶液等体积混合液
(7)已知醋酸能够和小苏打溶液发生下列反应:CH3COOH+NaHCO3═CH3COONa+CO2↑+H2O.用pH试纸在常温下分别测定0.10mol/L的醋酸钠溶液和0.10mol/L的碳酸氢钠溶液,则pH(CH3COONa)
查看习题详情和答案>>
(1)写出醋酸钠在水中发生水解反应的离子方程式:
CH3COO-+H2O?CH3COOH+OH-
CH3COO-+H2O?CH3COOH+OH-
;(2)在CH3COONa溶液中离子浓度由大到小的顺序为
c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
(用“c(Bn+)”表示相应离子浓度);(3)25℃时,醋酸的电离平衡常数表达式Ka=
| c(H+)?c(CH3COO-) | c(CH3COOH) |
2.88
2.88
(提示:醋酸的电离常数很小,平衡时的c(CH3COOH)可近似视为仍等于0.10mol/L; 已知:lg1.3=0.114);(4)对于醋酸溶液和醋酸钠溶液的下列说法正确的是
C
C
;A.稀释醋酸溶液,醋酸的电离程度增大,而稀释醋酸钠溶液则醋酸钠的水解程度减小.
B.升高温度可以促进醋酸电离,而升高温度则会抑制醋酸钠水解.
C.醋酸和醋酸钠的混合液中,醋酸抑制醋酸钠的水解、醋酸钠也抑制醋酸的电离.
D.醋酸和醋酸钠的混合液中,醋酸促进醋酸钠的水解、醋酸钠也促进醋酸的电离.
(5)物质的量浓度均为0.1mol/L的CH3COONa和CH3COOH溶液等体积混合(注:混合前后溶液体积变化忽略不计),混合液中的下列关系式正确的是
ABC
ABC
;A.c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-)
B.c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
C.c(CH3COO-)+c(CH3COOH)=0.1mol/L
(6)常温时,有以下3种溶液,其中pH最小的是
C
C
;A.0.02mol?L-1CH3COOH与0.02mol?L-1NaOH溶液等体积混合液
B.0.03mol?L-1CH3COOH与0.01mol?L-1NaOH溶液等体积混合液
C.pH=2的CH3COOH与pH=12的NaOH溶液等体积混合液
(7)已知醋酸能够和小苏打溶液发生下列反应:CH3COOH+NaHCO3═CH3COONa+CO2↑+H2O.用pH试纸在常温下分别测定0.10mol/L的醋酸钠溶液和0.10mol/L的碳酸氢钠溶液,则pH(CH3COONa)
<
<
pH(NaHCO3).(填:“>”、“<”或“=”)原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族.
(1)请写出Z元素在周期中的位置
(2)化合物甲由元素X与Y组成,1mol甲含18mol电子,请写出甲的化学式
(3)已知离子化合物乙由X、Y、Z、W四种元素组成,乙既能与盐酸反应,又能与氯水反应,1mol 乙能与过量NaOH浓溶液反应,最多可生成22.4L气体(标准状况).写出加热条件下乙与过量NaOH溶液反应的离子方程式
查看习题详情和答案>>
(1)请写出Z元素在周期中的位置
第二周期第ⅥA族
第二周期第ⅥA族
;(2)化合物甲由元素X与Y组成,1mol甲含18mol电子,请写出甲的化学式
N2H4
N2H4
;(3)已知离子化合物乙由X、Y、Z、W四种元素组成,乙既能与盐酸反应,又能与氯水反应,1mol 乙能与过量NaOH浓溶液反应,最多可生成22.4L气体(标准状况).写出加热条件下乙与过量NaOH溶液反应的离子方程式
NH4++HSO3-+OH-
NH3↑+SO32-+2H2O
| ||
NH4++HSO3-+OH-
NH3↑+SO32-+2H2O
.
| ||
硫酸工业中废渣称为硫酸渣,其成分为SiO2、Fe2O3、Al2O3、MgO.某探究性学习小组的同学设计以下方案,进行硫酸渣中金属元素的提取实验.
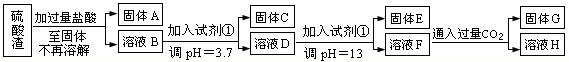
已知溶液pH=3.7时,Fe3+已经沉淀完全;一水合氨电离常数Kb=1.8×10-5,其饱和溶液中c(OH-)约为1×10-3mol?L-1.请回答:
(1)写出A与氢氧化钠溶液反应的化学方程式:
(2)上述流程中两次使用试剂①,推测试剂①应该是
A.氢氧化钠 B.氧化铝 C.氨水 D.水
(3)溶液D到固体E过程中需要控制溶液pH=13,如果pH过小,可能导致的后果是
(4)固体E为
(5)计算溶液F中c(Mg2+)=
查看习题详情和答案>>

已知溶液pH=3.7时,Fe3+已经沉淀完全;一水合氨电离常数Kb=1.8×10-5,其饱和溶液中c(OH-)约为1×10-3mol?L-1.请回答:
(1)写出A与氢氧化钠溶液反应的化学方程式:
SiO2+2NaOH=Na2SiO3+H2O
SiO2+2NaOH=Na2SiO3+H2O
.(2)上述流程中两次使用试剂①,推测试剂①应该是
A
A
(填以下字母编号)A.氢氧化钠 B.氧化铝 C.氨水 D.水
(3)溶液D到固体E过程中需要控制溶液pH=13,如果pH过小,可能导致的后果是
镁离子沉淀不完全或氢氧化铝溶解不完全等
镁离子沉淀不完全或氢氧化铝溶解不完全等
;(任写一点)(4)固体E为
Mg(OH)2
Mg(OH)2
,写出溶液F通入过量CO2生成固体G和溶液H的化学方程式:NaAlO2+CO2+H2O=Al(OH)3↓+NaHCO3
NaAlO2+CO2+H2O=Al(OH)3↓+NaHCO3
.(5)计算溶液F中c(Mg2+)=
5.6×10-10mol/L
5.6×10-10mol/L
(25℃时,氢氧化镁的Ksp=5.6×10-12)取一定量的PbI2固体用蒸馏水配成饱和溶液,量取25.00mLPbI2饱和溶液,分次慢慢加入交换柱,进行如下离子交换反应:Pb2+(aq)+2R-H(s)=R2Pb(s)+2H+(aq),用洁净的锥形瓶接流出液,待溶液流出后,再用蒸馏水淋洗树脂至流出液呈中性,将洗涤液一并放在锥形瓶中,加入指示剂,用0.0025mol/LNaOH溶液滴定,当达到滴定终点时,用去氢氧化钠溶液20.00mL.结合上述实验数据(已知lg2=0.3),下列有关说法正确的是( )
查看习题详情和答案>>
已知离子方程式:As2S3+H2O+N
→As
+S
+NO↑+____ (未配平),下列说法错误的是( )
(未配平),下列说法错误的是( )
| O | - 3 |
| O | 3- 4 |
| O | 2- 4 |
 (未配平),下列说法错误的是( )
(未配平),下列说法错误的是( )| A、配平后水的计量数为4 | ||||
| B、反应后溶液呈酸性 | ||||
| C、配平后氧化剂与还原剂的物质的量之比为3:28 | ||||
D、氧化产物为As
|