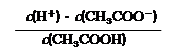题目内容
醋酸是日常生活中最常见的调味剂和重要的化工原料,醋酸钠是其常见的盐.(已知:25℃,Ka(CH3COOH)=1.69×10-5). 请回答:
(1)写出醋酸钠在水中发生水解反应的离子方程式:
(2)在CH3COONa溶液中离子浓度由大到小的顺序为
(3)25℃时,醋酸的电离平衡常数表达式Ka=
.0.10mol/L的醋酸溶液的pH约为
(4)对于醋酸溶液和醋酸钠溶液的下列说法正确的是
A.稀释醋酸溶液,醋酸的电离程度增大,而稀释醋酸钠溶液则醋酸钠的水解程度减小.
B.升高温度可以促进醋酸电离,而升高温度则会抑制醋酸钠水解.
C.醋酸和醋酸钠的混合液中,醋酸抑制醋酸钠的水解、醋酸钠也抑制醋酸的电离.
D.醋酸和醋酸钠的混合液中,醋酸促进醋酸钠的水解、醋酸钠也促进醋酸的电离.
(5)物质的量浓度均为0.1mol/L的CH3COONa和CH3COOH溶液等体积混合(注:混合前后溶液体积变化忽略不计),混合液中的下列关系式正确的是
A.c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-)
B.c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
C.c(CH3COO-)+c(CH3COOH)=0.1mol/L
(6)常温时,有以下3种溶液,其中pH最小的是
A.0.02mol?L-1CH3COOH与0.02mol?L-1NaOH溶液等体积混合液
B.0.03mol?L-1CH3COOH与0.01mol?L-1NaOH溶液等体积混合液
C.pH=2的CH3COOH与pH=12的NaOH溶液等体积混合液
(7)已知醋酸能够和小苏打溶液发生下列反应:CH3COOH+NaHCO3═CH3COONa+CO2↑+H2O.用pH试纸在常温下分别测定0.10mol/L的醋酸钠溶液和0.10mol/L的碳酸氢钠溶液,则pH(CH3COONa)
(1)写出醋酸钠在水中发生水解反应的离子方程式:
CH3COO-+H2O?CH3COOH+OH-
CH3COO-+H2O?CH3COOH+OH-
;(2)在CH3COONa溶液中离子浓度由大到小的顺序为
c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
(用“c(Bn+)”表示相应离子浓度);(3)25℃时,醋酸的电离平衡常数表达式Ka=
| c(H+)?c(CH3COO-) | c(CH3COOH) |
2.88
2.88
(提示:醋酸的电离常数很小,平衡时的c(CH3COOH)可近似视为仍等于0.10mol/L; 已知:lg1.3=0.114);(4)对于醋酸溶液和醋酸钠溶液的下列说法正确的是
C
C
;A.稀释醋酸溶液,醋酸的电离程度增大,而稀释醋酸钠溶液则醋酸钠的水解程度减小.
B.升高温度可以促进醋酸电离,而升高温度则会抑制醋酸钠水解.
C.醋酸和醋酸钠的混合液中,醋酸抑制醋酸钠的水解、醋酸钠也抑制醋酸的电离.
D.醋酸和醋酸钠的混合液中,醋酸促进醋酸钠的水解、醋酸钠也促进醋酸的电离.
(5)物质的量浓度均为0.1mol/L的CH3COONa和CH3COOH溶液等体积混合(注:混合前后溶液体积变化忽略不计),混合液中的下列关系式正确的是
ABC
ABC
;A.c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-)
B.c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
C.c(CH3COO-)+c(CH3COOH)=0.1mol/L
(6)常温时,有以下3种溶液,其中pH最小的是
C
C
;A.0.02mol?L-1CH3COOH与0.02mol?L-1NaOH溶液等体积混合液
B.0.03mol?L-1CH3COOH与0.01mol?L-1NaOH溶液等体积混合液
C.pH=2的CH3COOH与pH=12的NaOH溶液等体积混合液
(7)已知醋酸能够和小苏打溶液发生下列反应:CH3COOH+NaHCO3═CH3COONa+CO2↑+H2O.用pH试纸在常温下分别测定0.10mol/L的醋酸钠溶液和0.10mol/L的碳酸氢钠溶液,则pH(CH3COONa)
<
<
pH(NaHCO3).(填:“>”、“<”或“=”)分析:(1)醋酸根离子水解生成醋酸和氢氧根离子;
(2)醋酸根离子水解,溶液显碱性;
(3)平衡常数表达式Ka=
,0.10mol/L的醋酸溶液的c(H+)=
,以此计算pH;
(4)A.稀释促进电离、促进水解;
B.电离、水解均为吸热反应;
C.醋酸和醋酸钠的混合液中,电离与水解相互抑制;
D.醋酸和醋酸钠的混合液中,醋酸抑制醋酸钠的水解、醋酸钠也抑制醋酸的电离;
(5)物质的量浓度均为0.1mol/L的CH3COONa和CH3COOH溶液等体积混合,溶液显酸性,电荷守恒为c(Na+)+c(H+)=c(CH3COO-)+c(OH-),物料守恒为c(CH3COO-)+c(CH3COOH)=0.1mol/L=2c(Na+),以此分析;
(6)混合溶液的酸性越强,则pH越小,以此来解答;
(7)用pH试纸在常温下分别测定0.10mol/L的醋酸钠溶液和0.10mol/L的碳酸氢钠溶液,酸性越强,水解程度小,则碱性小,pH就小.
(2)醋酸根离子水解,溶液显碱性;
(3)平衡常数表达式Ka=
| c(H+)?c(CH3COO-) |
| c(CH3COOH) |
| Ka×c |
(4)A.稀释促进电离、促进水解;
B.电离、水解均为吸热反应;
C.醋酸和醋酸钠的混合液中,电离与水解相互抑制;
D.醋酸和醋酸钠的混合液中,醋酸抑制醋酸钠的水解、醋酸钠也抑制醋酸的电离;
(5)物质的量浓度均为0.1mol/L的CH3COONa和CH3COOH溶液等体积混合,溶液显酸性,电荷守恒为c(Na+)+c(H+)=c(CH3COO-)+c(OH-),物料守恒为c(CH3COO-)+c(CH3COOH)=0.1mol/L=2c(Na+),以此分析;
(6)混合溶液的酸性越强,则pH越小,以此来解答;
(7)用pH试纸在常温下分别测定0.10mol/L的醋酸钠溶液和0.10mol/L的碳酸氢钠溶液,酸性越强,水解程度小,则碱性小,pH就小.
解答:解:(1)醋酸根离子水解生成醋酸和氢氧根离子,离子反应为CH3COO-+H2O?CH3COOH+OH-,故答案为:CH3COO-+H2O?CH3COOH+OH-;
(2)醋酸根离子水解,溶液显碱性,显性离子大于隐性离子,则离子关系为c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故答案为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+);
(3)平衡常数表达式Ka=
,0.10mol/L的醋酸溶液的c(H+)=
=
=1.3×10-3mol/L,则pH=2.88,故答案为:2.88;
(4)A.稀释促进电离、促进水解,则稀释时醋酸的电离程度增大,醋酸钠的水解程度增大,故A错误;
B.电离、水解均为吸热反应,升高温度,促进水解、电离,故B错误;
C.醋酸和醋酸钠的混合液中,电离与水解相互抑制,故C正确;
D.醋酸和醋酸钠的混合液中,醋酸抑制醋酸钠的水解、醋酸钠也抑制醋酸的电离,故D错误;
故答案为:B;
(5)物质的量浓度均为0.1mol/L的CH3COONa和CH3COOH溶液等体积混合,溶液显酸性,电荷守恒为c(Na+)+c(H+)=c(CH3COO-)+c(OH-),物料守恒为c(CH3COO-)+c(CH3COOH)=0.1mol/L=2c(Na+),由上述两个式子可得c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-),故答案为:ABC;
(6)混合溶液的酸性越强,则pH越小,
A.0.02mol?L-1CH3COOH与0.02mol?L-1NaOH溶液等体积混合液,恰好生成醋酸钠,溶液显碱性;
B.0.03mol?L-1CH3COOH与0.01mol?L-1NaOH溶液等体积混合液,反应后为醋酸和醋酸钠的混合溶液,剩余0.01mol/L醋酸;
C.pH=2的CH3COOH与pH=12的NaOH溶液等体积混合液,反应后为醋酸和醋酸钠的混合溶液,pH=2的醋酸浓度大于远0.01mol/L,显然C酸性最大,pH最小,
故答案为:C;
(7)用pH试纸在常温下分别测定0.10mol/L的醋酸钠溶液和0.10mol/L的碳酸氢钠溶液,酸性越强,水解程度小,则碱性小,pH就小,
由CH3COOH+NaHCO3═CH3COONa+CO2↑+H2O可知,醋酸的酸性强,则醋酸钠水解程度小,盐溶液的pH小,故答案为:<.
(2)醋酸根离子水解,溶液显碱性,显性离子大于隐性离子,则离子关系为c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故答案为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+);
(3)平衡常数表达式Ka=
| c(H+)?c(CH3COO-) |
| c(CH3COOH) |
| Ka×c |
| 1.69×10-6 |
(4)A.稀释促进电离、促进水解,则稀释时醋酸的电离程度增大,醋酸钠的水解程度增大,故A错误;
B.电离、水解均为吸热反应,升高温度,促进水解、电离,故B错误;
C.醋酸和醋酸钠的混合液中,电离与水解相互抑制,故C正确;
D.醋酸和醋酸钠的混合液中,醋酸抑制醋酸钠的水解、醋酸钠也抑制醋酸的电离,故D错误;
故答案为:B;
(5)物质的量浓度均为0.1mol/L的CH3COONa和CH3COOH溶液等体积混合,溶液显酸性,电荷守恒为c(Na+)+c(H+)=c(CH3COO-)+c(OH-),物料守恒为c(CH3COO-)+c(CH3COOH)=0.1mol/L=2c(Na+),由上述两个式子可得c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-),故答案为:ABC;
(6)混合溶液的酸性越强,则pH越小,
A.0.02mol?L-1CH3COOH与0.02mol?L-1NaOH溶液等体积混合液,恰好生成醋酸钠,溶液显碱性;
B.0.03mol?L-1CH3COOH与0.01mol?L-1NaOH溶液等体积混合液,反应后为醋酸和醋酸钠的混合溶液,剩余0.01mol/L醋酸;
C.pH=2的CH3COOH与pH=12的NaOH溶液等体积混合液,反应后为醋酸和醋酸钠的混合溶液,pH=2的醋酸浓度大于远0.01mol/L,显然C酸性最大,pH最小,
故答案为:C;
(7)用pH试纸在常温下分别测定0.10mol/L的醋酸钠溶液和0.10mol/L的碳酸氢钠溶液,酸性越强,水解程度小,则碱性小,pH就小,
由CH3COOH+NaHCO3═CH3COONa+CO2↑+H2O可知,醋酸的酸性强,则醋酸钠水解程度小,盐溶液的pH小,故答案为:<.
点评:本题考查酸碱溶液的混合、涉及电离、水解、酸碱混合的定性判断及pH的计算等,注重高考常考考点的考查,侧重反应原理的训练,题目难度中等.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目