摘要: Fe2+.Fe3+的鉴别 ⑴观察法:Fe2+盐溶液呈 .Fe3+盐溶液呈 ⑵KSCN法:滴入KSCN无色溶液.溶液呈 者是Fe3+溶液. 者是Fe2+溶液. ⑶碱液法:分别加入碱液. 是Fe3+. 是Fe2+溶液.
网址:http://m.1010jiajiao.com/timu3_id_194298[举报]
一个体重50kg的健康人,体内约含有2g铁,这2g铁在人体内不是以单质的形式存在,而是以Fe2+ 和Fe3+的形式存在.正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁.服用维生素C,可将食物中的Fe3+转变成Fe2+,有利于人体吸收.
(1)在人体中进行下列转化时Fe2+
Fe3+,①中的Fe2+作 剂.
(2)“服用维生素C,可将食物中的Fe3+转化成Fe2+”这句话指出,维生素C在这一反应中作 剂,具有 性;某同学欲通过实验探究维生素C的这种性质,可选择的试剂是 (填字母).
a.酸性高锰酸钾溶液 b.碘水、淀粉 c.KI溶液
(3)维生素可根据其溶解性的不同分为水溶性维生素和脂溶性维生素两大类.维生素C属于 性维生素,由于它能防治坏血病,又称为抗坏血酸.
(4)黄瓜中含有多种营养成分,尤其是维生素C和B的含量比西瓜高出1~5倍.已知高温时维生素会被破坏,维生素C在酸性环境时较稳定.根据上述内容,你认为应如何合理的食用黄瓜?
(5)市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸的作用下转化成亚铁盐.此反应的离子方程式是 .
查看习题详情和答案>>
(1)在人体中进行下列转化时Fe2+
| ① | ② |
(2)“服用维生素C,可将食物中的Fe3+转化成Fe2+”这句话指出,维生素C在这一反应中作
a.酸性高锰酸钾溶液 b.碘水、淀粉 c.KI溶液
(3)维生素可根据其溶解性的不同分为水溶性维生素和脂溶性维生素两大类.维生素C属于
(4)黄瓜中含有多种营养成分,尤其是维生素C和B的含量比西瓜高出1~5倍.已知高温时维生素会被破坏,维生素C在酸性环境时较稳定.根据上述内容,你认为应如何合理的食用黄瓜?
(5)市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸的作用下转化成亚铁盐.此反应的离子方程式是
阅读下列材料后回答问题:一个体重50Kg的健康人,体内约含有2g铁,这2g铁在人体内不是以单质的形式存在,而是以Fe2+和Fe3+的形式存在.正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁.服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收.
(1)在人体中进行Fe2+
Fe3+的转化时,①中的Fe2+作
(2)“服用维生素C,可使食物中的Fe3+还原成Fe2+”这句话指出,维生素C在这一反应中作
(3)市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸(主要成分是盐酸)的作用下转化成亚铁盐.此反应的离子方程式为
(4)铁是日常生活中常见的金属元素,如果,将铁钉浸入硫酸铜溶液中,可以观察到有红色的铜生成,发生反应的离子方程式为
查看习题详情和答案>>
(1)在人体中进行Fe2+
| ① | ② |
还原
还原
剂,②中的Fe3+作氧化
氧化
剂.(2)“服用维生素C,可使食物中的Fe3+还原成Fe2+”这句话指出,维生素C在这一反应中作
还原
还原
剂.(3)市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸(主要成分是盐酸)的作用下转化成亚铁盐.此反应的离子方程式为
Fe+2HCl=FeCl2+H2↑
Fe+2HCl=FeCl2+H2↑
.在初中化学,我们常用上述反应来制备氢气,如果将56g铁投入到300ml物质的量浓度为1mol/L的盐酸中,生成的氢气在标准状况所占的体积是3.36L
3.36L
(4)铁是日常生活中常见的金属元素,如果,将铁钉浸入硫酸铜溶液中,可以观察到有红色的铜生成,发生反应的离子方程式为
Fe+Cu2+=Fe2++Cu
Fe+Cu2+=Fe2++Cu
,由此可知Cu2+的氧化性大于
大于
Fe2+的氧化性(填“大于”或者“小于”).(2009?徐汇区二模)有一瓶用硫酸酸化的FeSO4溶液,置于空气中一段时间后,溶液的pH=1.为测定其中Fe2+被氧化的百分率,进行如下操作:
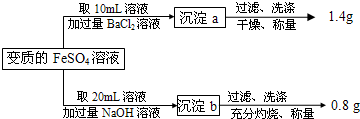
请计算(忽略Fe2+、Fe3+的水解):
(1)20mL变质的FeSO4溶液中,铁元素的总的物质的量为
(2)计算原溶液中Fe2+被氧化的百分率;
(3)原溶液中硫酸的物质的量浓度为
查看习题详情和答案>>

请计算(忽略Fe2+、Fe3+的水解):
(1)20mL变质的FeSO4溶液中,铁元素的总的物质的量为
0.01 mol
0.01 mol
;(2)计算原溶液中Fe2+被氧化的百分率;
(3)原溶液中硫酸的物质的量浓度为
0.1mol/L
0.1mol/L
.常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:2Fe2++H2O2+2H+=2Fe3++2H2O;
2Fe3++H2O2=2Fe2++O2+2H+
下列说法不正确的是( )
2Fe3++H2O2=2Fe2++O2+2H+
下列说法不正确的是( )
| A、H2O2在上述两个反应在都只做氧化剂 | B、在H2O2分解过程中,溶液C(H+)不变 | C、在H2O2分解过程中,Fe2+和Fe3+的总量保持不变 | D、H2O2生产过程要严格避免混入Fe2+ |
聚合硫酸铁(PFS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理.用铁的氧化物为原料来制取聚合硫酸铁,为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe2+.实验步骤如下:

(1)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有
(a)玻璃棒 (b)烧杯 (c)烧瓶
(2)步骤II取样分析溶液中Fe2+、Fe3+的含量,目的是
(a) 控制溶液中Fe2+与Fe3+含量比 (b) 确保铁的氧化物酸溶完全 (c) 确定下一步还原所需铁的量
(3)完成步骤IV中的氧化还原反应:补充产物并配平:
(4)聚合硫酸铁溶液中SO42?与Fe3+物质的量之比不是3:2.根据下列提供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中SO42?与Fe3+物质的量之比.测定时所需的试剂
(a) NaOH (b) FeSO4 (c) BaCl2 (d) NaClO3
需要测定Fe2O3和
查看习题详情和答案>>

(1)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有
ab
ab
.(a)玻璃棒 (b)烧杯 (c)烧瓶
(2)步骤II取样分析溶液中Fe2+、Fe3+的含量,目的是
C
C
和确定氧化Fe2+所需NaClO3的量:(a) 控制溶液中Fe2+与Fe3+含量比 (b) 确保铁的氧化物酸溶完全 (c) 确定下一步还原所需铁的量
(3)完成步骤IV中的氧化还原反应:补充产物并配平:
6
6
Fe2++1
1
ClO3-+6
6
H+=6
6
Fe3++Cl-+3H2O
3H2O
(4)聚合硫酸铁溶液中SO42?与Fe3+物质的量之比不是3:2.根据下列提供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中SO42?与Fe3+物质的量之比.测定时所需的试剂
ac
ac
.(a) NaOH (b) FeSO4 (c) BaCl2 (d) NaClO3
需要测定Fe2O3和
BaSO4
BaSO4
的质量(填写化合物的化学式).