题目内容
(2009?徐汇区二模)有一瓶用硫酸酸化的FeSO4溶液,置于空气中一段时间后,溶液的pH=1.为测定其中Fe2+被氧化的百分率,进行如下操作:
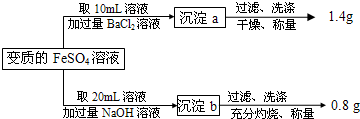
请计算(忽略Fe2+、Fe3+的水解):
(1)20mL变质的FeSO4溶液中,铁元素的总的物质的量为
(2)计算原溶液中Fe2+被氧化的百分率;
(3)原溶液中硫酸的物质的量浓度为

请计算(忽略Fe2+、Fe3+的水解):
(1)20mL变质的FeSO4溶液中,铁元素的总的物质的量为
0.01 mol
0.01 mol
;(2)计算原溶液中Fe2+被氧化的百分率;
(3)原溶液中硫酸的物质的量浓度为
0.1mol/L
0.1mol/L
.分析:本实验设计的依据是质量守恒定律,通过向变质的FeSO4溶液中加入过量BaCl2溶液产生的BaSO4沉淀的质量,可计算出SO42-总的物质的量,然后再利用加入过量NaOH溶液,得到沉淀并充分灼烧,得到Fe的氧化物的质量,通过Fe原子的质量守恒计算被氧化的Fe的质量.
解答:解:(1)加入过量NaOH溶液,得到沉淀并充分灼烧,得到Fe2O3质量为0.8g,依据铁元素守恒得到,铁元素物质的量=
×2=0.01mol;
故答案为:0.01 mol;
(2)设变质的硫酸亚铁中含Fe2+、Fe3+的物质的量分别为x、y,由pH=1得c(H+)=0.1 mol?L-1 ,20ml溶液中硫酸物质的量=0.020L×0.10mol/L×
=0.001mol则:
向变质的FeSO4溶液10ml中加入过量BaCl2溶液产生的BaSO4沉淀的质量,可计算出SO42-总的物质的量=
=0.006mol;20ml溶液中含有硫酸根离子物质的量为0.012mol;由x+y=0.01mol、x+
y+0.001=0.012mol可知,
x=0.008mol
y=0.002mol
原溶液中Fe2+被氧化的百分率=
×100%=20%;
故答案为:20%;
(3)溶液PH=1,氢离子浓度为0.1mol/L,原硫酸溶液浓度为0.05mol/L,故答案为:0.05mol/L.
| 0.8g |
| 160g/mol |
故答案为:0.01 mol;
(2)设变质的硫酸亚铁中含Fe2+、Fe3+的物质的量分别为x、y,由pH=1得c(H+)=0.1 mol?L-1 ,20ml溶液中硫酸物质的量=0.020L×0.10mol/L×
| 1 |
| 2 |
向变质的FeSO4溶液10ml中加入过量BaCl2溶液产生的BaSO4沉淀的质量,可计算出SO42-总的物质的量=
| 1.4g |
| 233g/mol |
| 3 |
| 2 |
x=0.008mol
y=0.002mol
原溶液中Fe2+被氧化的百分率=
| 0.002mol |
| 0.01mol |
故答案为:20%;
(3)溶液PH=1,氢离子浓度为0.1mol/L,原硫酸溶液浓度为0.05mol/L,故答案为:0.05mol/L.
点评:本题考查了物质组成的实验测定和分析计算,注意也是收获的计算应用是解题关键,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目