题目内容
一个体重50kg的健康人,体内约含有2g铁,这2g铁在人体内不是以单质的形式存在,而是以Fe2+ 和Fe3+的形式存在.正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁.服用维生素C,可将食物中的Fe3+转变成Fe2+,有利于人体吸收.(1)在人体中进行下列转化时Fe2+
| ① | ② |
(2)“服用维生素C,可将食物中的Fe3+转化成Fe2+”这句话指出,维生素C在这一反应中作
a.酸性高锰酸钾溶液 b.碘水、淀粉 c.KI溶液
(3)维生素可根据其溶解性的不同分为水溶性维生素和脂溶性维生素两大类.维生素C属于
(4)黄瓜中含有多种营养成分,尤其是维生素C和B的含量比西瓜高出1~5倍.已知高温时维生素会被破坏,维生素C在酸性环境时较稳定.根据上述内容,你认为应如何合理的食用黄瓜?
(5)市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸的作用下转化成亚铁盐.此反应的离子方程式是
分析:(1)①过程,Fe2+ 失电子生成 Fe3+,化合价升高,所以Fe2+ 是还原剂,还原剂化合价升高,具有还原性;
(2)服用维生素C,可使食物中的Fe3+还原为Fe2+,Fe3+转化为Fe2+,化合价降低,是氧化剂;维生素C是还原剂,具有还原性;
(3)维生素C溶液显酸性,又称为抗坏血酸,故为水溶性;
(4)因在酸性条件下,维生素C较稳定,因此食用黄瓜时可向其中加入少量的醋;高温时黄瓜中维生素损失较大,所以黄瓜不宜炒吃,以凉拌为佳.
(5)还原铁粉与胃酸的主要成份盐酸发生氧化还原反应;
(2)服用维生素C,可使食物中的Fe3+还原为Fe2+,Fe3+转化为Fe2+,化合价降低,是氧化剂;维生素C是还原剂,具有还原性;
(3)维生素C溶液显酸性,又称为抗坏血酸,故为水溶性;
(4)因在酸性条件下,维生素C较稳定,因此食用黄瓜时可向其中加入少量的醋;高温时黄瓜中维生素损失较大,所以黄瓜不宜炒吃,以凉拌为佳.
(5)还原铁粉与胃酸的主要成份盐酸发生氧化还原反应;
解答:解:(1)①过程,Fe2+ 失电子生成 Fe3+,化合价升高,所以Fe2+ 是还原剂,故答案为:还原;
(2)服用维生素C,可使食物中的Fe3+还原为Fe2+,Fe3+转化为Fe2+,化合价降低,是氧化剂;维生素C是还原剂,具有还原性,加氧化剂发生氧化还原,最伴随明显的颜色变化,故答案为:还原;还原;ab;
(3)维生素C溶液显酸性,又称为抗坏血酸,故为水溶性,故答案为:水溶;
(4)因在酸性条件下,维生素C较稳定,因此食用黄瓜时可向其中加入少量的醋;高温时黄瓜中维生素损失较大,所以黄瓜不宜炒吃,以凉拌为佳.
故答案为:加醋凉拌;
(5)还原铁粉与胃酸的主要成份盐酸发生氧化还原反应,离子方程式为Fe+2H+=Fe2++H2↑,故答案为:Fe+2H+=Fe2++H2↑;
(2)服用维生素C,可使食物中的Fe3+还原为Fe2+,Fe3+转化为Fe2+,化合价降低,是氧化剂;维生素C是还原剂,具有还原性,加氧化剂发生氧化还原,最伴随明显的颜色变化,故答案为:还原;还原;ab;
(3)维生素C溶液显酸性,又称为抗坏血酸,故为水溶性,故答案为:水溶;
(4)因在酸性条件下,维生素C较稳定,因此食用黄瓜时可向其中加入少量的醋;高温时黄瓜中维生素损失较大,所以黄瓜不宜炒吃,以凉拌为佳.
故答案为:加醋凉拌;
(5)还原铁粉与胃酸的主要成份盐酸发生氧化还原反应,离子方程式为Fe+2H+=Fe2++H2↑,故答案为:Fe+2H+=Fe2++H2↑;
点评:本题考查了氧化还原反应中氧化剂和还原剂概念的辨析,会运用给予信息解决问题,即会用知识迁移的方法解决问题.

练习册系列答案
相关题目
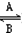 Fe3+的转化,A中Fe2+做
Fe3+的转化,A中Fe2+做