摘要:5.石灰石岩洞扩大 , 6.制生石灰 , 7用石灰乳抹墙 , 解析:除熟悉教科书中涉及的1.4.6.7知识外应具备常识.水垢的主要成份为不溶.可溶,, .应多读科普书.不断向生活和自然中现象提为什么.积累知识. 答案:1.A 2.C 3.C 4.D 5.B 6.D 7.A 例4.煤球炉燃烧过程中一般涉及到四个化合反应.它们是:
网址:http://m.1010jiajiao.com/timu3_id_194158[举报]
 能源是现代社会发展的支柱之一.
能源是现代社会发展的支柱之一.(1)化学反应中的能量变化,通常主要表现为热量的变化.
①下列反应中,属于放热反应的是
a.Ba(OH)2?8H2O与NH4Cl混合搅拌
b.高温煅烧石灰石
c.铝与盐酸反应
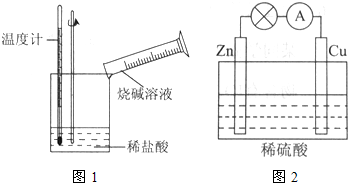
②某同学进行如图1所示实验,测量稀盐酸与烧碱溶液中和反应的能量变化.实验表明:反应温度升高,由此判断该反应是
(2)电能是现代社会应用最广泛的能源之一.如图2所示的原电池装置中,其负极是
 饱和氯水与石灰石的反应是制取较浓HClO溶液的方法之一.2005年的《化学教育》报道了如下实验研究:
饱和氯水与石灰石的反应是制取较浓HClO溶液的方法之一.2005年的《化学教育》报道了如下实验研究:实验一、定性研究:
①在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,有少量气泡产生,溶液黄绿色褪去.②过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强.③为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立即产生大量无色气体;
将第三份加热,看到溶液变浑且有大量无色气体产生.经检测,上述实验
中产生的无色气体均为CO2气体.
请回答:
(1)反应后所得的溶液漂白性增强的原因是
CaCO3消耗了氯水中的HC1,使Cl2+H2O HCl+HClO平衡向右移动,HClO浓度增大
HCl+HClO平衡向右移动,HClO浓度增大
 HCl+HClO平衡向右移动,HClO浓度增大
HCl+HClO平衡向右移动,HClO浓度增大CaCO3消耗了氯水中的HC1,使Cl2+H2O HCl+HClO平衡向右移动,HClO浓度增大
HCl+HClO平衡向右移动,HClO浓度增大
. HCl+HClO平衡向右移动,HClO浓度增大
HCl+HClO平衡向右移动,HClO浓度增大(2)写出步骤③中第一份及第三份滤液发生反应的离子方程式:第一份
Ca2++HCO3-+OH-=CaCO3↓+H2O
Ca2++HCO3-+OH-=CaCO3↓+H2O
;第三份Ca2++2HCO3-
CaCO3↓+CO2↑+H2O
| ||
Ca2++2HCO3-
CaCO3↓+CO2↑+H2O
.
| ||
(3)请推测②的滤液中含有的溶质除了极少量的氯气外,还有
HClO、Ca(HCO3)2、CaCl2
HClO、Ca(HCO3)2、CaCl2
.(填化学式)实验二、定量研究:
如图所示,在圆底烧瓶底部,有用塑料网包住的过量的块状碳酸钙,加入150mL饱和氯水,连接好装置,待不再产生气泡后,将塑料网中剩余的石灰石提出液面,再加热、煮沸烧瓶中的液体,直到量筒中的气体不再增加.
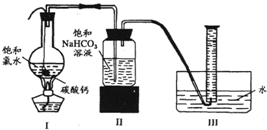
请回答:
(4)为减少用装置Ⅲ收集气体过程中CO2的损失,且水槽中仍然为水.请你对装置Ⅲ进行改进,最简单的方法是
在导管末端再连接长导管,使导管的出口接近量筒底部
在导管末端再连接长导管,使导管的出口接近量筒底部
;(5)用改进后的装置进行上述实验,测得塑料网内的碳酸钙质量减少A g,总共收集到标准状况的CO2气体B L,发现
| BL |
| 22.4L/mol |
| Ag |
| 100g/mol |
碳酸钙与氯水反应生成的Ca(HCO3)2受热时,除生成CO2外,还生成了CaCO3
碳酸钙与氯水反应生成的Ca(HCO3)2受热时,除生成CO2外,还生成了CaCO3
.(6)实验后发现,装置Ⅱ中的液体增多了,其原因是
从圆底烧瓶蒸出的水蒸气在广口瓶中冷凝、聚集
从圆底烧瓶蒸出的水蒸气在广口瓶中冷凝、聚集
. 图表法、图象法是常用的科学研究方法.
图表法、图象法是常用的科学研究方法.(Ⅰ)电离能是指由蒸气状态的孤立原子失去电子形成阳离子需要的能量.从中性原子中移去第一个电子所需要的能量为第一电离能(I1),移去第二个电子所需要的能量为第二电离能(I2),依次类推.
现有5种元素L、M、N、O、P,其I1~I3分别如下表,根据表中数据判断其中的金属元素有
M、N、O
M、N、O
,稀有气体元素是P
P
,最活泼的金属是M
M
,显二价的金属是O
O
.| 元 素 | I1/eV | I2/eV | I3/eV |
| L | 13.0 | 23.9 | 40.0 |
| M | 4.3 | 31.9 | 47.8 |
| N | 5.7 | 47.4 | 71.8 |
| O | 7.7 | 15.1 | 80.3 |
| P | 21.6 | 41.1 | 65.2 |
(1)该反应的化学方程式为
2P+3Q?2M
2P+3Q?2M
(2)若M、P、Q均为气体,反应达平衡时:
①体系的压强是开始时的
| 13 |
| 16 |
| 13 |
| 16 |
0.02mol/L?min
0.02mol/L?min
②若此时只将容器的体积扩大为原来的2倍,达新平衡时,容器内温度将降低(容器不与外界进行热交换),则该反应为
放热
放热
反应(填“放热”或“吸热”);达新平衡时,容器内混合气体的平均分子量比原平衡时减小
减小
(填增大、减小或相等).(3)此反应达平衡后,若只加大体系压强,M的物质的量增加,若M是气体,则Q的聚集状态是
气态
气态
.写出下列反应的离子方程式:
(1)石灰石溶于稀盐酸
(6)铜与硝酸银溶液
查看习题详情和答案>>
(1)石灰石溶于稀盐酸
CaCO3+2H+=Ca2++H2O+CO2↑
CaCO3+2H+=Ca2++H2O+CO2↑
(2)稀硫酸与氢氧化钡溶液的反应2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
(3)碳酸氢钠溶液与盐酸反应H++HCO3-=H2O+CO2↑
H++HCO3-=H2O+CO2↑
(4)氢氧化铜与稀硫酸反应Cu(OH)2+2H+═Cu2++2H2O
Cu(OH)2+2H+═Cu2++2H2O
(5)向澄清石灰水中通入少量的二氧化碳Ca2++2OH-+CO2═CaCO3↓+H2O
Ca2++2OH-+CO2═CaCO3↓+H2O
(6)铜与硝酸银溶液
Cu+2Ag+=Cu2++2Ag
Cu+2Ag+=Cu2++2Ag
(7)氧化镁溶于稀硫酸MgO+2H+═Mg2++H2O
MgO+2H+═Mg2++H2O
.下列说法正确的是( )
| A、pH在5.6~7.0之间的降水通常称为酸雨 | B、燃煤时加入适量石灰石,可减少废气中SO2的量 | C、新制氯水经光照一段时间pH增大 | D、测定某溶液pH应先用蒸馏水润湿pH试纸 |