题目内容
 能源是现代社会发展的支柱之一.
能源是现代社会发展的支柱之一.(1)化学反应中的能量变化,通常主要表现为热量的变化.
①下列反应中,属于放热反应的是
a.Ba(OH)2?8H2O与NH4Cl混合搅拌
b.高温煅烧石灰石
c.铝与盐酸反应
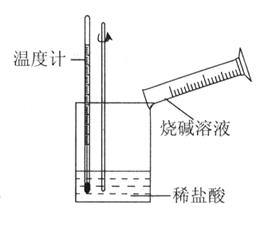
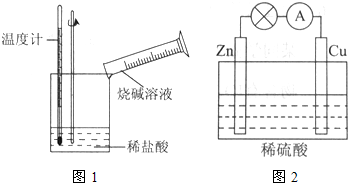
②某同学进行如图1所示实验,测量稀盐酸与烧碱溶液中和反应的能量变化.实验表明:反应温度升高,由此判断该反应是
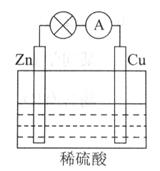
(2)电能是现代社会应用最广泛的能源之一.如图2所示的原电池装置中,其负极是
分析:(1)①根据常见的放热反应有:所有的物质燃烧、所有金属与酸反应、金属与水反应,所有中和反应;绝大多数化合反应和铝热反应;
常见的吸热反应有:绝大数分解反应,个别的化合反应(如C和CO2),少数分解置换以及某些复分解(如铵盐和强碱),C或氢气做还原剂时的反应;
②中和反应是放热反应;
(2)根据金属的活泼性分析,根据消耗的金属的量计算生成气体的量.
常见的吸热反应有:绝大数分解反应,个别的化合反应(如C和CO2),少数分解置换以及某些复分解(如铵盐和强碱),C或氢气做还原剂时的反应;
②中和反应是放热反应;
(2)根据金属的活泼性分析,根据消耗的金属的量计算生成气体的量.
解答:解:(1)①a.Ba(OH)2?8H2O与NH4Cl混合搅拌是吸热反应,故错误;
b.高温煅烧石灰石是吸热反应,故错误;
c.铝与盐酸反应是放热反应,故正确;
故答案为:c;
②中和反应是放热反应,离子方程式为H++OH-=H2O,故答案为:放热;H++OH-=H2O;
(2)由于锌比铜活泼,所以锌作负极,所以消耗的金属为锌.
锌失电子生成锌离子进入溶液,电极反应式为锌片:Zn-2e-=Zn2+,铜片上氢离子得电子生成氢气,所以电极反应式为2H++2e-=H2↑,
总反应:Zn+2H+=H2↑+Zn2+
65g 2g
6.5g Xg
=
解得X为0.2g.
故答案为:Zn;铜片表面产生无色气泡; 2H++2e-=H2↑;0.2.
b.高温煅烧石灰石是吸热反应,故错误;
c.铝与盐酸反应是放热反应,故正确;
故答案为:c;
②中和反应是放热反应,离子方程式为H++OH-=H2O,故答案为:放热;H++OH-=H2O;
(2)由于锌比铜活泼,所以锌作负极,所以消耗的金属为锌.
锌失电子生成锌离子进入溶液,电极反应式为锌片:Zn-2e-=Zn2+,铜片上氢离子得电子生成氢气,所以电极反应式为2H++2e-=H2↑,
总反应:Zn+2H+=H2↑+Zn2+
65g 2g
6.5g Xg
| 65g |
| 6.5g |
| 2g |
| Xg |
解得X为0.2g.
故答案为:Zn;铜片表面产生无色气泡; 2H++2e-=H2↑;0.2.
点评:本题以原电池为载体考查了氧化还原反应的有关计算,明确各物理量之间的关系是解本题的关键,难度不大.

练习册系列答案
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案
相关题目
能源是现代社会发展的三大支柱之一。化学在提高能源的利用率和开发新能源中起到了重要的作用。
(1)下列说法中,正确的是 。(填序号)
| A.煤、石油和天然气都是可再生的能源 |
| B.目前使用的手机电池为二次电池,放电时是将化学能转化为电能 |
| C.人体运动所消耗的能量与化学反应无关 |
| D.人类目前所直接利用的能量大部分是由化学反应产生的 |
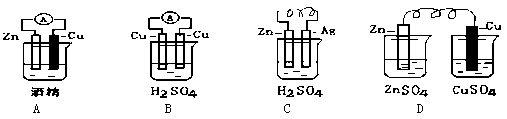
(3)锌锰干电池是目前使用最广泛的一种电池,其正极材料是石墨棒,它在放电时总反应式可表示为:Zn+ 2 MnO2 + 2 NH4+ ="=" Zn2+ + Mn2O3(S)+ 2NH3 + H2O。写出该电池负极反应的电极反应式 。当电极锌消耗6.5g时,可对外提供的电子是 mol。
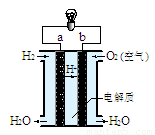
(4)右图是氢氧燃料电池构造示意图(电解质溶液为稀硫酸)。关于该电池的说法不正确的是
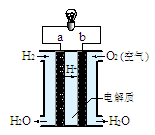
①.a极是负极
②.正极的电极反应是:O2+2H2O+4e-=4OH-
③.该装置可以将化学能完全转化为电能
④.氢氧燃料电池是环保电池
(5)人类在使用能源的过程中会产生环境问题。利用化学反应可以有效的进行治理。减少汽车等机动车尾气污染可在汽车尾气系统中增加催化转化装置,尾气中的CO、NO在催化剂的作用下反应生成两种参与大气循环的无毒气体,写出该反应的化学方程式 。
 能源是现代社会发展的支柱之一,化学能是重要的能源.
能源是现代社会发展的支柱之一,化学能是重要的能源.