摘要:40].配平Cl2+AgF+H2O-AgClO3+AgCl+HF+O2时有无穷多组系数.如5.10.5-1.9.10.1或7.14.7-1.13.14.2,--.若H2O前面的系数为11.写出配平后的系数 若a.b.c--为任意自然数.试用字母配平方程式.并能反映出所有情况:
网址:http://m.1010jiajiao.com/timu3_id_194071[举报]
在2KMnO4+
反应中:
(1)配平化学反应方程式.
(2)
(3)用单线桥标出该反应中电子转移的方向和数目
 .
.
(4)氯气通入氯化亚铁溶液中,溶液变成黄色,写出反应的离子方程式
(5)生成标准状况下氯气4.48L,需要消耗高锰酸钾
查看习题详情和答案>>
16
16
HCl═2
2
KC1+2
2
MnC12+5
5
Cl2↑+8
8
H2O反应中:
(1)配平化学反应方程式.
(2)
Cl
Cl
元素被氧化,KMnO4
KMnO4
是氧化剂(3)用单线桥标出该反应中电子转移的方向和数目


(4)氯气通入氯化亚铁溶液中,溶液变成黄色,写出反应的离子方程式
Cl2+2Fe2+=2Fe3=+2Cl-
Cl2+2Fe2+=2Fe3=+2Cl-
.(5)生成标准状况下氯气4.48L,需要消耗高锰酸钾
0.08
0.08
mol,过程中转移电子数0.4
0.4
mol.碘酸钾是一种白色结晶粉末,无臭无味,酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸、二氧化硫等还原性物质作用,被还原为单质碘,在碱性介质中,碘酸钾能被氯气、次氯酸盐等氧化为高碘酸钾.碘酸钾在常温下稳定,加热至560℃开始分解.工业生产碘酸钾的流程如下,在反应器中发生反应的化学方程式为:I2+KClO3+H2O--KH(IO3)2+KCl+Cl2↑(未配平)

(1)已知步骤①反应器发生的反应中,两种还原产物所得电子数相同,请配平该反应的化学方程式:
(2)步骤②中,用稀酸酸化的作用是
(3)步骤③要保持溶液微沸1小时以完全排出氯气,排出氯气的原因为
(4)参照下表碘酸钾的溶解度,步骤11得到碘酸钾晶体,你建议的方法是
查看习题详情和答案>>

(1)已知步骤①反应器发生的反应中,两种还原产物所得电子数相同,请配平该反应的化学方程式:
6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑
6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑
;(2)步骤②中,用稀酸酸化的作用是
促进氯气从反应混合物中逸出
促进氯气从反应混合物中逸出
;不能选用稀盐酸的原因是盐酸能还原已生成的碘酸氢钾
盐酸能还原已生成的碘酸氢钾
;(3)步骤③要保持溶液微沸1小时以完全排出氯气,排出氯气的原因为
Cl2能将KIO3氧化成KIO4
Cl2能将KIO3氧化成KIO4
;(4)参照下表碘酸钾的溶解度,步骤11得到碘酸钾晶体,你建议的方法是
蒸发结晶
蒸发结晶
.| 温度/℃ | 0 | 10 | 20 | 40 | 60 | 80 |
| KIO3g/100g水 | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |
(1)已知:AgF+Cl2+H2O→AgCl+AgClO3+HF+O2(未配平).若Cl2的化学计量数为a,则AgF的化学计量数为
若AgClO3的化学计量数为b,O2的计量数为c,则AgCl的化学计量数为
(2)某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3ASO4、H2O和一种未知物质X.
①已知KBrO3在反应中得到电子,则该反应的还原剂是
②已知0.2molKBrO3在反应中得到1mol电子生成X,则X的化学式为
③根据上述反应可推知
a.氧化性:KBrO3>H3AsO4 b.氧化性:H3AsO>KBrO3
c.还原性:AsH3>X d.还原性:X>AsH3
④将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目(请一定要用单线桥表示、凡是用双线桥表示的不得分):
查看习题详情和答案>>
2a
2a
,判断的依据是据反应前后Ag原子数不变,AgF的化学计量数等于AgCl和AgClO3化学计量数之和,据反应前后Cl原子数不变,AgCl和AgClO3化学计量数之和即AgF的化学计量数等于Cl2化学计量数的二倍
据反应前后Ag原子数不变,AgF的化学计量数等于AgCl和AgClO3化学计量数之和,据反应前后Cl原子数不变,AgCl和AgClO3化学计量数之和即AgF的化学计量数等于Cl2化学计量数的二倍
;若AgClO3的化学计量数为b,O2的计量数为c,则AgCl的化学计量数为
5b+4c
5b+4c
,判断的依据是根据化合价升降总和相等,AgCl的化学计量数应等于AgClO3化学计量数的5倍与O2化学计量数的4倍之和
根据化合价升降总和相等,AgCl的化学计量数应等于AgClO3化学计量数的5倍与O2化学计量数的4倍之和
.(2)某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3ASO4、H2O和一种未知物质X.
①已知KBrO3在反应中得到电子,则该反应的还原剂是
AsH3
AsH3
.②已知0.2molKBrO3在反应中得到1mol电子生成X,则X的化学式为
Br2
Br2
.③根据上述反应可推知
a、c
a、c
.a.氧化性:KBrO3>H3AsO4 b.氧化性:H3AsO>KBrO3
c.还原性:AsH3>X d.还原性:X>AsH3
④将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目(请一定要用单线桥表示、凡是用双线桥表示的不得分):
8KBrO3
8KBrO3
+5AsH3
5AsH3
.某化学兴趣小组测定某Fe2(SO4)3样品(只含少量Fec12杂质)中铁元素的质量分数,按以下实验步骤进行操作:
①称取ag样品,置于烧杯中;
②加入50mL 1.0mol/L稀硫酸和一定量的蒸馏水,使样品溶解,然后准确配制成250.00mL溶液;
③量取25.00mL步骤 ②中配得的溶液,置于烧杯中,加入适量的氯水,使反应完全;
④加入过量氨水,充分搅拌,使沉淀完全;
⑤过滤,洗涤沉淀;
⑥将沉淀转移到某容器内,加热、搅拌,直到固体由红褐色全部变为红棕色后,在干燥器中冷却至室温后,称量;
⑦…
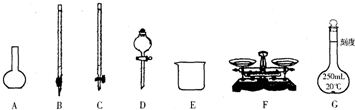
请根据上面叙述,回答:
(1)上图所示仪器中,本实验步骤①②③中必须用到的仪器有E和 (填字母).
(2)步骤②中:配制50mL,1.0mol/L稀H2SO4需要98%(密度1.84g/cm3)的浓H2SO4体积为 mL,量取该体积的浓H2SO4用到量筒规格是 .
(3)样品中的杂质Fe2+有较强的还原性,完成并配平下列反应的离子方程式
Fe2++ ClO2+ ═ Fe3++ Cl-+ H2O
从理论上分析,上述实验中若将氯水改为ClO2时,对实验结果造成 (填偏大、偏小或不影响),等物质的量的ClO2与Cl2的氧化效率之比为 .
(4)第⑥步的操作中,将沉淀物转移到 (填仪器名称)中加热,冷却至室温,称量其质量为m1g,再次加热并冷却至室温称量其质量为m2g,若m1与m2差值较大,接下来的操作应当是 .
(5)若步骤⑥不在干燥器中冷却,则测定的铁元素的质量分数会 (填偏大、偏小或不影响);若容器质量是W1g,最终容器和固体的总质量是W2g,则样品中铁元素的质量分数为 ,(列出算式,不需化简)
查看习题详情和答案>>
①称取ag样品,置于烧杯中;
②加入50mL 1.0mol/L稀硫酸和一定量的蒸馏水,使样品溶解,然后准确配制成250.00mL溶液;
③量取25.00mL步骤 ②中配得的溶液,置于烧杯中,加入适量的氯水,使反应完全;
④加入过量氨水,充分搅拌,使沉淀完全;
⑤过滤,洗涤沉淀;
⑥将沉淀转移到某容器内,加热、搅拌,直到固体由红褐色全部变为红棕色后,在干燥器中冷却至室温后,称量;
⑦…

请根据上面叙述,回答:
(1)上图所示仪器中,本实验步骤①②③中必须用到的仪器有E和
(2)步骤②中:配制50mL,1.0mol/L稀H2SO4需要98%(密度1.84g/cm3)的浓H2SO4体积为
(3)样品中的杂质Fe2+有较强的还原性,完成并配平下列反应的离子方程式
从理论上分析,上述实验中若将氯水改为ClO2时,对实验结果造成
(4)第⑥步的操作中,将沉淀物转移到
(5)若步骤⑥不在干燥器中冷却,则测定的铁元素的质量分数会
用氯气对饮用水消毒已有百年历史.这种消毒方法会使饮用水中的有机物发生氯代反应,生成有机含氯化合物,对人体有害,且氯气本身也是一种有毒气体.世界环保联盟即将全面禁止用氯气对饮用水消毒,建议推广采用广谱性高效消毒剂二氧化氯(ClO2).目前欧洲一些国家用NaClO3氧化浓盐酸来制取ClO2,同时有Cl2生成,反应的化学方程式为:
(1)配平上述化学方程式.
(2)此反应中氧化剂是:
(3)在标准状况下有4.48L氯气生成时,转移的电子数为
(4)我国研制成功用氯气氧化亚氯酸钠(在氮气保护下)制得ClO2,表示这一反应的化学方程式是2NaClO2+Cl2═2ClO2↑+2A.已知A物质是一种盐,它的化学式为
查看习题详情和答案>>
2
2
NaClO3+4
4
HCl═2
2
NaCl+2
2
ClO2↑+1
1
Cl2↑+2
2
H2O.(1)配平上述化学方程式.
(2)此反应中氧化剂是:
NaClO3
NaClO3
,在反应中盐酸体现的性质是还原性
还原性
和酸性
酸性
;(3)在标准状况下有4.48L氯气生成时,转移的电子数为
0.4
0.4
mol,被氧化的盐酸的物质的量为0.4
0.4
mol.(4)我国研制成功用氯气氧化亚氯酸钠(在氮气保护下)制得ClO2,表示这一反应的化学方程式是2NaClO2+Cl2═2ClO2↑+2A.已知A物质是一种盐,它的化学式为
NaCl
NaCl
.这一方法的优点是不产生有毒的氯气,减小对环境的污染
不产生有毒的氯气,减小对环境的污染
.