题目内容
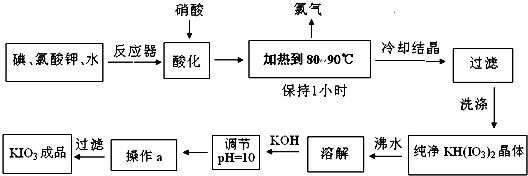
碘酸钾是一种白色结晶粉末,无臭无味,酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸、二氧化硫等还原性物质作用,被还原为单质碘,在碱性介质中,碘酸钾能被氯气、次氯酸盐等氧化为高碘酸钾.碘酸钾在常温下稳定,加热至560℃开始分解.工业生产碘酸钾的流程如下,在反应器中发生反应的化学方程式为:I2+KClO3+H2O--KH(IO3)2+KCl+Cl2↑(未配平)
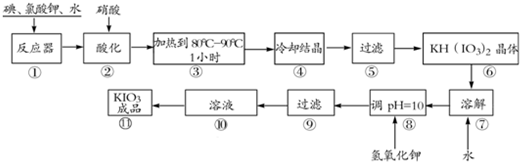
(1)已知步骤①反应器发生的反应中,两种还原产物所得电子数相同,请配平该反应的化学方程式:
(2)步骤②中,用稀酸酸化的作用是
(3)步骤③要保持溶液微沸1小时以完全排出氯气,排出氯气的原因为
(4)参照下表碘酸钾的溶解度,步骤11得到碘酸钾晶体,你建议的方法是

(1)已知步骤①反应器发生的反应中,两种还原产物所得电子数相同,请配平该反应的化学方程式:
6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑
6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑
;(2)步骤②中,用稀酸酸化的作用是
促进氯气从反应混合物中逸出
促进氯气从反应混合物中逸出
;不能选用稀盐酸的原因是盐酸能还原已生成的碘酸氢钾
盐酸能还原已生成的碘酸氢钾
;(3)步骤③要保持溶液微沸1小时以完全排出氯气,排出氯气的原因为
Cl2能将KIO3氧化成KIO4
Cl2能将KIO3氧化成KIO4
;(4)参照下表碘酸钾的溶解度,步骤11得到碘酸钾晶体,你建议的方法是
蒸发结晶
蒸发结晶
.| 温度/℃ | 0 | 10 | 20 | 40 | 60 | 80 |
| KIO3g/100g水 | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |
分析:(1)反应中I2→KH(IO3)2,I元素化合价由0价升高为+5价,共升高10价.KClO3→KCl、Cl2,氯元素化合价降低,还原产物为KCl、Cl2,KClO3→KCl氯元素化合价由+5降低为-1价,化合价降低6价,KClO3→Cl2氯元素化合价由+5降低为0价,化合价总共降低10价,二者获得的电子数目相同,获得电子最小公倍数为30,则KCl的系数为5,Cl2的系数为3,所以化合价降低60价,故I2系数为6,根据元素守恒配平KClO3、H2O、KH(IO3)2的系数.
(2)由信息可知,碘酸钾能被氯气氧化,由工艺流程可知酸化的目的是将氯气从反应混合物中逸出.
酸性条件下碘酸钾是一种较强的氧化剂,能氧化盐酸,被还原.
(3)由信息可知,碘酸钾能被氯气氧化高碘酸钾.
(4)由表中数据可知温度越高,KIO3溶解度越大,从溶液中获得晶体需要蒸发结晶.
(2)由信息可知,碘酸钾能被氯气氧化,由工艺流程可知酸化的目的是将氯气从反应混合物中逸出.
酸性条件下碘酸钾是一种较强的氧化剂,能氧化盐酸,被还原.
(3)由信息可知,碘酸钾能被氯气氧化高碘酸钾.
(4)由表中数据可知温度越高,KIO3溶解度越大,从溶液中获得晶体需要蒸发结晶.
解答:解:(1)反应中I2→KH(IO3)2,I元素化合价由0价升高为+5价,共升高10价.KClO3→KCl、Cl2,氯元素化合价降低,还原产物为KCl、Cl2,KClO3→KCl氯元素化合价由+5降低为-1价,化合价降低6价,KClO3→Cl2氯元素化合价由+5降低为0价,化合价总共降低10价,二者获得的电子数目相同,获得电子最小公倍数为30,则KCl的系数为5,Cl2的系数为3,所以化合价降低共60价,故I2系数为6,根据氯元素守恒可知KClO3系数为11,根据碘元素守恒可知KH(IO3)2的系数为6,根据氢元素守恒可知H2O、系数为3,检查氧元素守恒,故方程式为:6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑.
故答案为:6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑.
(2)由信息可知,碘酸钾能被氯气氧化,由工艺流程可知酸化的目的是将氯气从反应混合物中逸出.
酸性条件下碘酸钾是一种较强的氧化剂,盐酸能还原已生成的碘酸氢钾.
故答案为:促进氯气从反应混合物中逸出;盐酸能还原已生成的碘酸氢钾.
(3)由信息可知,碘酸钾能被氯气氧化为高碘酸钾,所以要将完全排出氯气,防止碘酸钾被氧化.
故答案为:Cl2能将KIO3氧化成KIO4.
(4)由表中数据可知温度越高,KIO3溶解度越大,从溶液中获得KIO3晶体需要蒸发结晶.
故答案为:蒸发结晶.
故答案为:6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑.
(2)由信息可知,碘酸钾能被氯气氧化,由工艺流程可知酸化的目的是将氯气从反应混合物中逸出.
酸性条件下碘酸钾是一种较强的氧化剂,盐酸能还原已生成的碘酸氢钾.
故答案为:促进氯气从反应混合物中逸出;盐酸能还原已生成的碘酸氢钾.
(3)由信息可知,碘酸钾能被氯气氧化为高碘酸钾,所以要将完全排出氯气,防止碘酸钾被氧化.
故答案为:Cl2能将KIO3氧化成KIO4.
(4)由表中数据可知温度越高,KIO3溶解度越大,从溶液中获得KIO3晶体需要蒸发结晶.
故答案为:蒸发结晶.
点评:本题考查氧化还原反应、阅读题目获取信息、对工艺流程的理解等,难度中等,需要学生具备根据信息进行分析问题、解决问题的能力.

练习册系列答案
 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
相关题目

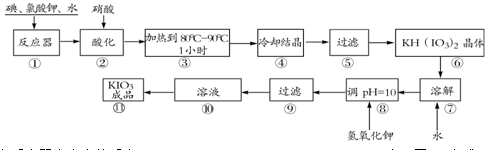
 得到碘酸钾晶体,你建议的方法是
得到碘酸钾晶体,你建议的方法是