摘要:4].离子反应为aMnO4-+bI-+H+→Mn2++cI2 +dIO3-+H2O,根据该离子方程式.下列说法正确的是 A 氧化性MnO4->IO3- B c=d=5.则该反应转移电子数为30e- C a.b.c.d之间的关系是:5a=2c+6d,b=2c+d D 当反应物的相对量或浓度发生改变时.化学计量数一定有c=d
网址:http://m.1010jiajiao.com/timu3_id_194035[举报]
据统计,每年世界上银总消耗量的40%用于感光材料的生产,感光材料经曝光、显影、定影后,黑白片上的银80%左右进入定影液,彩色片上的银几乎全部进入废定影液,所以废定影液中银的含量是十分惊人的.
某研究性学习小组拟对某照相公司的废定影液进行实验处理,回收其中的银和溴.
(一) 资料支撑:
①定影液(硫代硫酸钠,Na2S2O3)跟胶片或相纸上没有感光部分的溴化银反应,反应方程式为:
AgBr(s)+2Na2S2O3(aq)=Na3[Ag(S2O3)2](aq)+NaBr(aq).
②在酸的作用下,Na3[Ag(S2O3)2]能转化为不溶性的Ag2S.反应原理为:
6HCl+2Na3[Ag(S2O3)2]=6NaCl+Ag2S↓+3S↓+3SO2↑+H2SO4+2H2O.
③溶液中有少量溴化银,可用锌将其还原出来.
(二) 实验程序设计
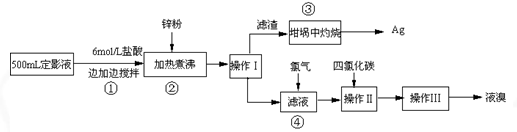
(三) 试回答下列问题
(1)本实验需用6mol/L的盐酸250mL,配制时除需量筒、烧杯、玻璃棒外,还需用的仪器有: 、 .
(2)指出流程图中操作所包含的装置是(填序号:A、B、C)Ⅰ Ⅱ Ⅲ .

(3)步骤③是在空气中灼烧的.该反应的化学方程式: .实验操作时,加入适量的硝酸钾加盖后再灼热,加硝酸钾的目的可能是: .
(4)加入锌粉发生的离子反应为: .
查看习题详情和答案>>
某研究性学习小组拟对某照相公司的废定影液进行实验处理,回收其中的银和溴.
(一) 资料支撑:
①定影液(硫代硫酸钠,Na2S2O3)跟胶片或相纸上没有感光部分的溴化银反应,反应方程式为:
AgBr(s)+2Na2S2O3(aq)=Na3[Ag(S2O3)2](aq)+NaBr(aq).
②在酸的作用下,Na3[Ag(S2O3)2]能转化为不溶性的Ag2S.反应原理为:
6HCl+2Na3[Ag(S2O3)2]=6NaCl+Ag2S↓+3S↓+3SO2↑+H2SO4+2H2O.
③溶液中有少量溴化银,可用锌将其还原出来.
(二) 实验程序设计

(三) 试回答下列问题
(1)本实验需用6mol/L的盐酸250mL,配制时除需量筒、烧杯、玻璃棒外,还需用的仪器有:
(2)指出流程图中操作所包含的装置是(填序号:A、B、C)Ⅰ

(3)步骤③是在空气中灼烧的.该反应的化学方程式:
(4)加入锌粉发生的离子反应为:
常温下,如果取0.2mol/LCH3COOH溶液与0.2mol/L NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的PH=9,试回答以下问题:
(1)写出该混合过程中所发生反应的离子方程式:
(2)混合溶液中由水电离出的c(H+)和PH=9的NaOH溶液中由水电离出c(H+)的比值为
(3)求混合溶液中下列算式的计算结果:
c(Na+)-c(CH3COO-)=
c(OH-)-c(CH3COOH)=
(4)若HCl溶液与NaOH溶液反应的中和热数值为53.7kJ/mol,则1molCH3COOH与1mol NaOH在溶液中反应所放出的热与57.3kJ/mol相比会
(5)将同温度下等浓度的下列四种盐溶液:
A.NH4HCO3 B.NH4Cl C.(NH4)2SO4 D.CH3COONH4
按PH由大到小的顺序排列:
查看习题详情和答案>>
(1)写出该混合过程中所发生反应的离子方程式:
HAc+OH-=Ac-+H2O
HAc+OH-=Ac-+H2O
,混合溶液的PH=9的原因是:(用必要的文字和离子方程式表示)Ac-离子水解显碱性,离子反应为Ac-+H2O?HAc+OH-
Ac-离子水解显碱性,离子反应为Ac-+H2O?HAc+OH-
.(2)混合溶液中由水电离出的c(H+)和PH=9的NaOH溶液中由水电离出c(H+)的比值为
104:1
104:1
.(3)求混合溶液中下列算式的计算结果:
c(Na+)-c(CH3COO-)=
10-5-10-9
10-5-10-9
mol/L(列出算式即可)c(OH-)-c(CH3COOH)=
10-9
10-9
moL/L(写出精确结果.)(4)若HCl溶液与NaOH溶液反应的中和热数值为53.7kJ/mol,则1molCH3COOH与1mol NaOH在溶液中反应所放出的热与57.3kJ/mol相比会
偏小
偏小
(“相等”或“偏大”、“偏小”.)(5)将同温度下等浓度的下列四种盐溶液:
A.NH4HCO3 B.NH4Cl C.(NH4)2SO4 D.CH3COONH4
按PH由大到小的顺序排列:
ADBC
ADBC
(填字母序号.)三氧化二铁和氧化亚铜都是红色粉末,常用作颜料.某校化学实验小组通过实验探究某红色粉末是Fe2O3、Cu2O或二者混合物.探究过程如下:
查阅资料:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4.
设计探究实验:取少量粉末放入足量稀硫酸中,在所得溶液中滴加KSCN试剂.
(1)若只有Fe2O3,则实验现象是
(2)若固体粉末完全溶解无固体存在,滴加KSCN试剂时溶液不变红色,则此过程中的离子反应为:
(3)经实验分析,确定红色粉末为Cu2O和Fe2O3的混合物.实验小组欲测定Cu2O的质量分数.已知Cu2O在空气中加热生成CuO.
测定流程:

实验中操作A的名称为
灼烧过程中,所需仪器有:酒精灯、玻璃棒、
(4)写出混合物中Cu2O的质量分数的表达式
(或
%)
(或
%).
实验小组欲利用红色粉末制取较纯净的胆矾(CuSO4?5H2O).经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下:
实验室有下列试剂可供选择:A.氯水 B.H2O2 C.NaOH D.Cu2(OH)2CO3
实验小组设计如下实验方案制取胆矾:
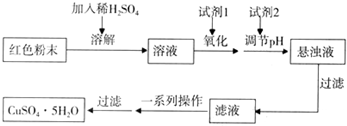
(5)用试剂编号表示:试剂l为
(6)为什么先“氧化”后“调节pH”?pH控制范围为多少?
查看习题详情和答案>>
查阅资料:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4.
设计探究实验:取少量粉末放入足量稀硫酸中,在所得溶液中滴加KSCN试剂.
(1)若只有Fe2O3,则实验现象是
固体完全溶解,溶液呈血红色
固体完全溶解,溶液呈血红色
.(2)若固体粉末完全溶解无固体存在,滴加KSCN试剂时溶液不变红色,则此过程中的离子反应为:
Fe2O3+6H+═2Fe3++3H2O Cu2O+2H+═Cu+Cu2++H2O2Fe3++Cu═2Fe2++Cu2+
Fe2O3+6H+═2Fe3++3H2O Cu2O+2H+═Cu+Cu2++H2O2Fe3++Cu═2Fe2++Cu2+
.(3)经实验分析,确定红色粉末为Cu2O和Fe2O3的混合物.实验小组欲测定Cu2O的质量分数.已知Cu2O在空气中加热生成CuO.
测定流程:

实验中操作A的名称为
恒重操作
恒重操作
.灼烧过程中,所需仪器有:酒精灯、玻璃棒、
坩埚
坩埚
等(夹持仪器除外).(4)写出混合物中Cu2O的质量分数的表达式
| 9(b-a) |
| a |
| 900(b-a) |
| a |
| 9(b-a) |
| a |
| 900(b-a) |
| a |
实验小组欲利用红色粉末制取较纯净的胆矾(CuSO4?5H2O).经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下:
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
实验小组设计如下实验方案制取胆矾:

(5)用试剂编号表示:试剂l为
B
B
,试剂2为D
D
.(6)为什么先“氧化”后“调节pH”?pH控制范围为多少?
由于亚铁离子和铜离子开始沉淀、沉淀完全的pH值很接近,难以分离,把亚铁离子氧化为铁离子,pH控制范围:3.7<pH<6将铁离子转化为沉淀而被除去
由于亚铁离子和铜离子开始沉淀、沉淀完全的pH值很接近,难以分离,把亚铁离子氧化为铁离子,pH控制范围:3.7<pH<6将铁离子转化为沉淀而被除去
. Ⅰ用元素符号或化学式回答原子序数11~18的元素的有关问题:
Ⅰ用元素符号或化学式回答原子序数11~18的元素的有关问题:(1)除稀有气体外,原子半径最大的元素是
Na
Na
;(2)最高价氧化物对应水化物呈两性的元素是
Al
Al
;(3)最高正价氧化物对应水化物酸性最强的酸是
HClO4
HClO4
;(4)能形成气态氢化物且氢化物最稳定的元素是
Cl
Cl
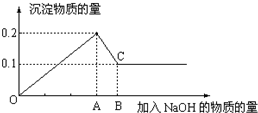
.Ⅱ在MgCl2和AlCl3的混和溶液中,逐滴加入NaOH溶液直至过量,经测定,加入NaOH的物质的量和所得沉淀的物质的量的关系如下图所示,则溶液中n(Mg2+):n(Al3+)=
1:1
1:1
,AB段发生的离子反应为Al(OH)3+OH-═AlO2-+2H2O
Al(OH)3+OH-═AlO2-+2H2O
.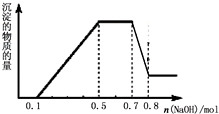 溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①加入铝片,产生无色无味的气体;②加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )
溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①加入铝片,产生无色无味的气体;②加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )| A、溶液中一定不含CO32-,可能含有SO42-和NO3- | B、在滴加NaOH溶液物质的量为0.5至0.7mol时,发生的离子反应为:Al3++4OH-=[Al(OH)4]- | C、溶液中的阳离子只有H+、Mg2+、Al3+ | D、n(H+):n(NH4+):n(Mg2+)=2:4:1 |