题目内容
据统计,每年世界上银总消耗量的40%用于感光材料的生产,感光材料经曝光、显影、定影后,黑白片上的银80%左右进入定影液,彩色片上的银几乎全部进入废定影液,所以废定影液中银的含量是十分惊人的.某研究性学习小组拟对某照相公司的废定影液进行实验处理,回收其中的银和溴.
(一) 资料支撑:
①定影液(硫代硫酸钠,Na2S2O3)跟胶片或相纸上没有感光部分的溴化银反应,反应方程式为:
AgBr(s)+2Na2S2O3(aq)=Na3[Ag(S2O3)2](aq)+NaBr(aq).
②在酸的作用下,Na3[Ag(S2O3)2]能转化为不溶性的Ag2S.反应原理为:
6HCl+2Na3[Ag(S2O3)2]=6NaCl+Ag2S↓+3S↓+3SO2↑+H2SO4+2H2O.
③溶液中有少量溴化银,可用锌将其还原出来.
(二) 实验程序设计
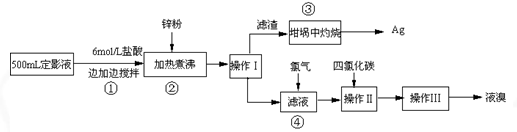
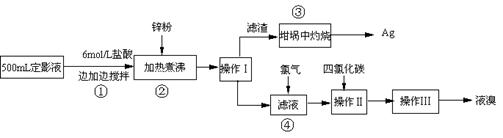
(三) 试回答下列问题
(1)本实验需用6mol/L的盐酸250mL,配制时除需量筒、烧杯、玻璃棒外,还需用的仪器有:
(2)指出流程图中操作所包含的装置是(填序号:A、B、C)Ⅰ

(3)步骤③是在空气中灼烧的.该反应的化学方程式:
(4)加入锌粉发生的离子反应为:
分析:(1)根据配制一定体积一定物质的量浓度的溶液需要的仪器来回答;
(2)根据流程的操作来选择所需要的仪器;
(3)过滤实现固体和液体之间的分离;分液实现互不相溶液体的分离,蒸馏可以实现互溶的但是沸点不同的物质的分离;
(4)金属锌具有还原性,能将其后面的金属从其盐中置换出来.
(2)根据流程的操作来选择所需要的仪器;
(3)过滤实现固体和液体之间的分离;分液实现互不相溶液体的分离,蒸馏可以实现互溶的但是沸点不同的物质的分离;
(4)金属锌具有还原性,能将其后面的金属从其盐中置换出来.
解答:解:(1)配制6mol/L的盐酸250mL需要的仪器有:250mL容量瓶、胶头滴管、量筒、烧杯、玻璃棒等,故答案为:容量瓶、胶头滴管;
(2)流程中的操作分别是:操作Ⅰ为实现固体和液体的分离,即为过滤,选择C装置,操作Ⅱ是实现溴单质和水之间的分离,可以用萃取分液法,选择B装置,操作Ⅲ可以实现互溶的溴单质和四氯化碳之间的分离,应采用蒸馏法,选择A装置,故答案为:C;B;A;
(3)由Ag2S在氧气中灼烧,除了有银生成外,还有一种气体生成,可知反应物是Ag2S和O2,生成物有银,根据质量守恒定律可知生成物中气体是由硫元素和氧元素组成,所以是二氧化硫,即Ag2S+O2
2Ag+SO2,实验操作时,加入适量的硝酸钾加盖后再灼热,加入适量的硝酸钾可以释放氧气,使硫化银完全被氧化,
故答案为:Ag2S+O2
2Ag+SO2;释放氧气,使硫化银完全被氧化;
(4)金属锌具有还原性,加入锌粉于溴化银中,可以置换出银,即2AgBr+Zn=Ag+Zn2++2Br-,故答案为:2AgBr+Zn=Ag+Zn2++2Br-.
(2)流程中的操作分别是:操作Ⅰ为实现固体和液体的分离,即为过滤,选择C装置,操作Ⅱ是实现溴单质和水之间的分离,可以用萃取分液法,选择B装置,操作Ⅲ可以实现互溶的溴单质和四氯化碳之间的分离,应采用蒸馏法,选择A装置,故答案为:C;B;A;
(3)由Ag2S在氧气中灼烧,除了有银生成外,还有一种气体生成,可知反应物是Ag2S和O2,生成物有银,根据质量守恒定律可知生成物中气体是由硫元素和氧元素组成,所以是二氧化硫,即Ag2S+O2
| ||
故答案为:Ag2S+O2
| ||
(4)金属锌具有还原性,加入锌粉于溴化银中,可以置换出银,即2AgBr+Zn=Ag+Zn2++2Br-,故答案为:2AgBr+Zn=Ag+Zn2++2Br-.
点评:本题是一道物质的分离和提纯知识的综合应用题,考查学生分析和解决问题的能力,难度不大.

练习册系列答案
 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案
相关题目