摘要:含非极性共价键的离子化合物:Na+[O-O]2-Na+.过氧化钾.FeS2.CaC2电石.苯酚钠
网址:http://m.1010jiajiao.com/timu3_id_193747[举报]
(1)下列有关晶体的叙述中错误的是
A.石英晶体中的硅原子以sp2杂化方式与周围的氧原子形成共价键
B.氯化钠晶体中每个Na+或Cl-周围紧邻的有6个Cl-或Na+
C.在CsCl晶体中每个Cs+周围紧邻的有8个Cl-,而和每个Cl-等距离紧邻的也有8个Cs+
D.在面心立方密堆积的金属晶体中,每个金属原子周围紧邻的有4个金属原子
(2)已知MgO的晶体结构属于NaCl型.某同学画出的MgO晶胞结构示意图如图1所示,请改正图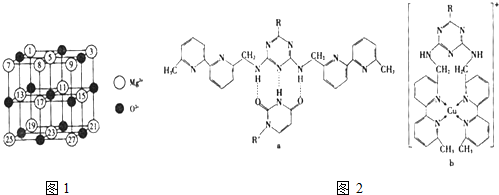
中错误: .(用文字表述)
(3)第三周期部分元素氟化物的熔点见下表:
解释表中氟化物熔点差异的原因: .
(4)人工模拟是当前研究的热点.有研究表明,化合物X可用于研究模拟酶,当其结合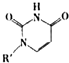 或Cu(I)(I表示化合价为+1)时,分别形成a和b:
或Cu(I)(I表示化合价为+1)时,分别形成a和b:
分析a和b中微粒间的相互作用(包括化学键和分子间相互作用)的差异,试指出
其不同点:a中含 ,b中含 .(用“氢键”、“配位键”、“极性键”、“非极性键”等填空)
查看习题详情和答案>>
A.石英晶体中的硅原子以sp2杂化方式与周围的氧原子形成共价键
B.氯化钠晶体中每个Na+或Cl-周围紧邻的有6个Cl-或Na+
C.在CsCl晶体中每个Cs+周围紧邻的有8个Cl-,而和每个Cl-等距离紧邻的也有8个Cs+
D.在面心立方密堆积的金属晶体中,每个金属原子周围紧邻的有4个金属原子
(2)已知MgO的晶体结构属于NaCl型.某同学画出的MgO晶胞结构示意图如图1所示,请改正图

中错误:
(3)第三周期部分元素氟化物的熔点见下表:
| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/K | 1266 | 1534 | 183 |
(4)人工模拟是当前研究的热点.有研究表明,化合物X可用于研究模拟酶,当其结合
 或Cu(I)(I表示化合价为+1)时,分别形成a和b:
或Cu(I)(I表示化合价为+1)时,分别形成a和b:分析a和b中微粒间的相互作用(包括化学键和分子间相互作用)的差异,试指出
其不同点:a中含
A、B、C、D、E都是短周期元素,原子序数依次增大;A原子中电子运动的轨道只有一种形状;B、C同周期,A、D同主族.D、B能形成两种离子化合物甲和乙,原子个数比分别为2:1和1:1;E元素原子的最外层电子数是其电子总数的
.根据以上信息回答下列问题:
(1)甲、乙中含有非极性键的物质的电子式是
 .
.
(2)E、C分别形成的氢化物稳定性大小关系是
(3)C和D的离子中,半径较小的是
 ,
,
 .
.
(4)写出B元素基态原子的轨道表示式
 .
.
(5)X是与E同主族的短周期元素,下表列出了X原子间各种共价键的键能:
通过计算说明X2中的
查看习题详情和答案>>
| 1 |
| 3 |
(1)甲、乙中含有非极性键的物质的电子式是


(2)E、C分别形成的氢化物稳定性大小关系是
HF>PH3
HF>PH3
.(用氢化物的化学式作答)(3)C和D的离子中,半径较小的是
Na+
Na+
(填离子符号).画出C和D的离子的结构示意图



(4)写出B元素基态原子的轨道表示式


(5)X是与E同主族的短周期元素,下表列出了X原子间各种共价键的键能:
| 键类型 | X-X | X=X | X≡X |
| 键能(kJ/mol) | 159 | 418 | 946 |
π键比σ键稳定
π键比σ键稳定
(填“σ键比π键稳定”或“π键比σ键稳定”).(1) 在下列化合物中:H2O2 、Na2O、、I2 、、NaCl、、CO2、NH4Cl、Na2O2,用化学式回答下列问题:
在下列化合物中:H2O2 、Na2O、、I2 、、NaCl、、CO2、NH4Cl、Na2O2,用化学式回答下列问题: 只由非金属组成的离子化合物是 ,
只由非金属组成的离子化合物是 ,
只有极性共价键的共价化合物是 , 只含有非极性共价键的是 ,
只含有非极性共价键的是 ,
既有离子键又有非极性键的化合物是 。
(2)在下列物质中,① Li ②
Li ② Na ③
Na ③ Mg ④
Mg ④ Li ⑤
Li ⑤ C ⑥C60 ⑦石墨,为同位素的是 ,互为同素异形体的是 。(填编号)
C ⑥C60 ⑦石墨,为同位素的是 ,互为同素异形体的是 。(填编号)
 Li ②
Li ② Na ③
Na ③ Mg ④
Mg ④ Li ⑤
Li ⑤ C ⑥C60 ⑦石墨,为同位素的是 ,互为同素异形体的是 。(填编号)
C ⑥C60 ⑦石墨,为同位素的是 ,互为同素异形体的是 。(填编号) 在下列化合物中:H2O2 、Na2O、、I2 、、NaCl、、CO2、NH4Cl、Na2O2,用化学式回答下列问题:
在下列化合物中:H2O2 、Na2O、、I2 、、NaCl、、CO2、NH4Cl、Na2O2,用化学式回答下列问题: Li ②
Li ② Na ③
Na ③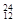 Mg ④
Mg ④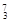 Li ⑤
Li ⑤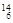 C ⑥C60 ⑦石墨,为同位素的是 ,互为同素异形体的是 。(填编号)
C ⑥C60 ⑦石墨,为同位素的是 ,互为同素异形体的是 。(填编号)