网址:http://m.1010jiajiao.com/timu3_id_193343[举报]
[2012·课标全国卷] (14分)铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)要确定铁的某氯化物为FeClx的化学式,可用离子交换和滴定的方法。实验中称取0.54 g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40 mol·L-1的盐酸滴定,滴至终点时消耗盐酸25.0 mL。计算该样品中氯的物质的量,并求出FeClx中x值:________________(列出计算过程);
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe)∶n(Cl)=1∶2.1,则该样品中FeCl3的物质的量分数为________。在实验中,FeCl2可用铁粉和________反应制备,FeCl3可用铁粉和________反应制备;
(3)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为__________________;
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为
______________________________;与MnO2—Zn电池类似,K2FeO4—Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为________________________,该电池总反应的离子方程式为_____________________________________。
[2012·课标全国卷] (14分)铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)要确定铁的某氯化物为FeClx的化学式,可用离子交换和滴定的方法。实验中称取0.54 g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40 mol·L-1的盐酸滴定,滴至终点时消耗盐酸25.0 mL。计算该样品中氯的物质的量,并求出FeClx中x值:________________(列出计算过程);
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe)∶n(Cl)=1∶2.1,则该样品中FeCl3的物质的量分数为________。在实验中,FeCl2可用铁粉和________反应制备,FeCl3可用铁粉和________反应制备;
(3)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为__________________;
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为
______________________________;与MnO2—Zn电池类似,K2FeO4—Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为________________________,该电池总反应的离子方程式为_____________________________________。
查看习题详情和答案>>
 某课外活动小组欲利用下列装置(部分固定装置略)完成下列实验;
某课外活动小组欲利用下列装置(部分固定装置略)完成下列实验;(一)实验目的:测定铜粉(含炭)样品中铜的质量分数
(二)实验用品:仪器:天平、分液漏斗、锥形瓶、硬玻璃管、干燥管、酒精灯、洗气瓶药品:红褐色铜粉(含炭)样品、过氧化氢溶液、二氧化锰、碱石灰.浓硫酸等
(三)实验内容:
| 步骤 | 实验过程 | 实验现象 | 有关化学方程式 |
| 1 | / | / | |
| 2 | 在C中加入样品W克,D中装入碱石 灰后并称量为m1克.连接好仪器,打开A的活塞,慢慢加溶液. |
||
| 3 | 对C进行加热.当C中药品充分反应后.关闭A的活塞.停止加热: | ||
| 4 | 冷却后,称量D的质量为m2克. | / | / |
W-
| ||
| W |
W-
| ||
| W |
(五)问题和讨论:
该小组重复测定了三次,得到铜的质量分数的数据存在较大的偏差,你认为原因可能是
A.装置内原有空气中的二氧化碳气体也被碱石灰吸收
B.装置B中的产生的气体中的水蒸气通过C被D中碱石灰吸收
C.反应完成后,装置中的二氧化碳没有全部被碱石灰吸收.
(1)在人体中进行下列转化时Fe2+
| ① | ② |
(2)“服用维生素C,可将食物中的Fe3+转化成Fe2+”这句话指出,维生素C在这一反应中作
a.酸性高锰酸钾溶液 b.碘水、淀粉 c.KI溶液
(3)维生素可根据其溶解性的不同分为水溶性维生素和脂溶性维生素两大类.维生素C属于
(4)黄瓜中含有多种营养成分,尤其是维生素C和B的含量比西瓜高出1~5倍.已知高温时维生素会被破坏,维生素C在酸性环境时较稳定.根据上述内容,你认为应如何合理的食用黄瓜?
(5)市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸的作用下转化成亚铁盐.此反应的离子方程式是

请回答下列问题:
(1)写出A中反应的化学方程式并用单线桥标出电子转移的方向和数目
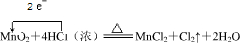
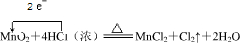
(2)洗气瓶B中试剂是
(3)从绿色化学的角度考虑该装置中有一明显不合理之处,请你提出改进的意见
(4)反应开始后装置D中出现浓厚的白烟并在容器内壁凝结,活动小组拟继续通过实验鉴定该固体的成分.请你协助他们完成该实验探究.
取固体样品加少量水溶解,分装于两支试管中.
步骤①:加入硝酸酸化的硝酸银,产生白色沉淀;
步骤②: