题目内容
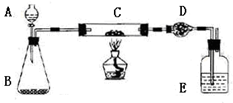 某课外活动小组欲利用下列装置(部分固定装置略)完成下列实验;
某课外活动小组欲利用下列装置(部分固定装置略)完成下列实验;(一)实验目的:测定铜粉(含炭)样品中铜的质量分数
(二)实验用品:仪器:天平、分液漏斗、锥形瓶、硬玻璃管、干燥管、酒精灯、洗气瓶药品:红褐色铜粉(含炭)样品、过氧化氢溶液、二氧化锰、碱石灰.浓硫酸等
(三)实验内容:
| 步骤 | 实验过程 | 实验现象 | 有关化学方程式 |
| 1 | / | / | |
| 2 | 在C中加入样品W克,D中装入碱石 灰后并称量为m1克.连接好仪器,打开A的活塞,慢慢加溶液. |
||
| 3 | 对C进行加热.当C中药品充分反应后.关闭A的活塞.停止加热: | ||
| 4 | 冷却后,称量D的质量为m2克. | / | / |
W-
| ||
| W |
W-
| ||
| W |
(五)问题和讨论:
该小组重复测定了三次,得到铜的质量分数的数据存在较大的偏差,你认为原因可能是
ABC
ABC
.A.装置内原有空气中的二氧化碳气体也被碱石灰吸收
B.装置B中的产生的气体中的水蒸气通过C被D中碱石灰吸收
C.反应完成后,装置中的二氧化碳没有全部被碱石灰吸收.
分析:(三)步骤1、由装置图与步骤2、3、4可知,该实验原理是:利用A中双氧水分解生成的氧气,在装置C中氧气将样品中的碳氧化为二氧化碳,利用干燥管D中的质量增重测定生成的二氧化碳的质量,根据二氧化碳的质量计算,样品中碳的质量,进而计算样品中铜的质量分数.故实验按图连接好仪器后,检查装置的气密性;
步骤2、实验开始B中在二氧化锰作催化剂条件下双氧水分解生成氧气与水,故装置B、E中有气泡产生;
步骤3、装置C中发生反应2Cu+O2
2CuO,C+O2
CO2,C中红色的铜转化为黑色的氧化铜;
(四)根据装置D的前后质量可知,生成的二氧化碳的质量为(m2-m1)g,计算碳的质量m(C),样品中铜的质量m(Cu)=m(样品)-m(C),再根据质量分数定义计算样品中铜的质量分数;
(五)A.装置内原有空气中的二氧化碳气体,被碱石灰吸收,导致测定的二氧化碳的质量偏大,测定样品中碳的质量偏大;
B.装置B中的产生的气体中的水蒸气通过C被D中碱石灰吸收,导致测定的二氧化碳的质量偏大,测定样品中碳的质量偏大;
C.反应完成后,装置中的二氧化碳没有全部被碱石灰吸收,导致测定的二氧化碳的质量偏小,测定样品中碳的质量偏小.
步骤2、实验开始B中在二氧化锰作催化剂条件下双氧水分解生成氧气与水,故装置B、E中有气泡产生;
步骤3、装置C中发生反应2Cu+O2
| ||
| ||
(四)根据装置D的前后质量可知,生成的二氧化碳的质量为(m2-m1)g,计算碳的质量m(C),样品中铜的质量m(Cu)=m(样品)-m(C),再根据质量分数定义计算样品中铜的质量分数;
(五)A.装置内原有空气中的二氧化碳气体,被碱石灰吸收,导致测定的二氧化碳的质量偏大,测定样品中碳的质量偏大;
B.装置B中的产生的气体中的水蒸气通过C被D中碱石灰吸收,导致测定的二氧化碳的质量偏大,测定样品中碳的质量偏大;
C.反应完成后,装置中的二氧化碳没有全部被碱石灰吸收,导致测定的二氧化碳的质量偏小,测定样品中碳的质量偏小.
解答:解:(三)步骤1、由装置图与步骤2、3、4可知,该实验原理是:利用A中双氧水分解生成的氧气,在装置C中氧气将样品中的碳氧化为二氧化碳,利用干燥管D中的质量增重测定生成的二氧化碳的质量,根据二氧化碳的质量计算,样品中碳的质量,进而计算样品中铜的质量分数.故实验按图连接好仪器后,检查装置的气密性.
步骤2、实验开始B中在二氧化锰作催化剂条件下双氧水发生分解反应2H2O2
2H2O+O2↑,生成氧气与水,故装置B、E中有气泡产生.
步骤3、装置C中发生反应2Cu+O2
2CuO,C+O2
CO2,C中红色的铜转化为黑色的氧化铜,现象为C中红色粉末变成黑色.
故答案为:
(四)根据装置D的前后质量可知,生成的二氧化碳的质量为(m2-m1)g,样品中碳的质量m(C)=
×(m2-m1)g,样品中铜的质量m(Cu)=Wg-
×(m2-m1)g,样品中铜的质量分数为
,故答案为:
;
(五)A.装置内原有空气中的二氧化碳气体,被碱石灰吸收,导致测定的二氧化碳的质量偏大,测定样品中碳的质量偏大,样品中铜的质量偏小,导致铜的质量分数存在较大的偏差,故A符合;
B.装置B中的产生的气体中的水蒸气通过C被D中碱石灰吸收,导致测定的二氧化碳的质量偏大,测定样品中碳的质量偏大,样品中铜的质量偏小,导致铜的质量分数存在较大的偏差,故B符合;
C.反应完成后,装置中的二氧化碳没有全部被碱石灰吸收,导致测定的二氧化碳的质量偏小,测定样品中碳的质量偏小,样品中铜的质量偏大,导致铜的质量分数存在较大的偏差,故C符合.
故选:ABC.
步骤2、实验开始B中在二氧化锰作催化剂条件下双氧水发生分解反应2H2O2
| ||
步骤3、装置C中发生反应2Cu+O2
| ||
| ||
故答案为:
| 步骤 | 实验过程 | 实验现象 | 有关化学方程式 | ||||||||
| 1 | 按图连接好仪器后,检查装置的气密性 | ----------- | ---------- | ||||||||
| 2 | ---------- | B、E中有气泡产生 | 2H2O2
| ||||||||
| 3 | ---------- | C中红色粉末变成黑色 | 2Cu+O2
C+O2
| ||||||||
| 4 | ---------- | ---------- | ---------- |
| 12 |
| 44 |
| 12 |
| 44 |
W-
| ||
| W |
W-
| ||
| W |
(五)A.装置内原有空气中的二氧化碳气体,被碱石灰吸收,导致测定的二氧化碳的质量偏大,测定样品中碳的质量偏大,样品中铜的质量偏小,导致铜的质量分数存在较大的偏差,故A符合;
B.装置B中的产生的气体中的水蒸气通过C被D中碱石灰吸收,导致测定的二氧化碳的质量偏大,测定样品中碳的质量偏大,样品中铜的质量偏小,导致铜的质量分数存在较大的偏差,故B符合;
C.反应完成后,装置中的二氧化碳没有全部被碱石灰吸收,导致测定的二氧化碳的质量偏小,测定样品中碳的质量偏小,样品中铜的质量偏大,导致铜的质量分数存在较大的偏差,故C符合.
故选:ABC.
点评:本题考查对实验原理的理解与实验操作评价、物质含量测定、化学计算等,难度中等,理解实验原理是关键,是对所学知识的综合运用,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力,学习中全面把握基础知识.

练习册系列答案
相关题目
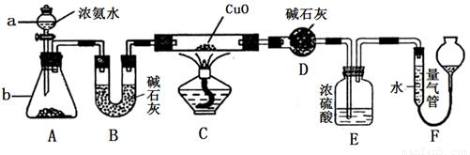
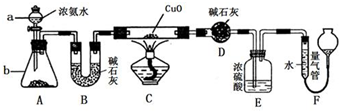 某课外活动小组欲利用氨气与CuO反应,研究氨气的性质并测其组成,设计了如图实验(夹持装置未画出)进行实验.请回答下列问题:
某课外活动小组欲利用氨气与CuO反应,研究氨气的性质并测其组成,设计了如图实验(夹持装置未画出)进行实验.请回答下列问题: