摘要:(二)元素性质的递变规律: 1.同一周期的主族元素的递变规律: ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 1 第三周期 Na Mg Al Si P S Cl 2 原子半 径变化 3 元素性 质递变 4 主要化 合价 5 最高价氧化物通式 6 最高价氧化物的水化物通式 7 上述水化物的性质递变规律 8 气态氢化物的通式 9 上述氢化物的稳定性递变 10 对应离子的符号 11 离子的性质变化 2.同一主族元素的性质递变规律: 周期 原子 半径 金属性 最高价氧化物水化物 离子 半径 阳离子氧化性 阴离子还原性 氢化物 稳定性 最高价氧化物水化物 非金 属性 原子 半径 1 2 3 4 5 6 7 3.元素周期表中“位 “构 “性 相互关系: 练习题:1.X.Y.Z为同周期元素.已知最高价氧化物的水化物的酸性强弱是HXO4>H2YO4>H3ZO4.则下列判断不正确的是 A 原子半径X>Y>Z B 非金属性X>Y>Z C 气态氢化物的稳定性X>Y>Z D 阴离子的还原性X>Y>Z 2.短周期元素X和Y能形成XY4化合物.若X的原子序数为m.Y的原子序数为n.则m和n的关系不可能是 A m-13=n B m+5=n C m+8=n D m-11=n 4.若某元素其原子序数是88号元素.下列关于此元素的性质的描述不正确的是 A 其最高价氧化物的水化物加热分解 B 单质与水反应放出氢气 C 氢氧化物呈两性 D 碳酸盐难溶于水
网址:http://m.1010jiajiao.com/timu3_id_193188[举报]
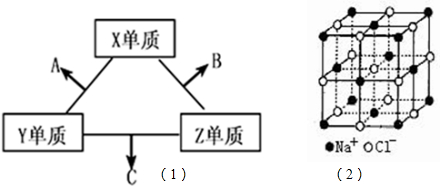
(2013?济南一模)短周期元素在元素中占有重要地位.X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如(1)变化:
一个B分子中含有的Z原子个数比C分子中少1个,B、C两种分子中的电子数均等于10.请回答下列问题:
(1)X元素在周期表中的位置是
(2)分析同主族元素性质的递变规律,发现B、C物质沸点反常,这是因为它们的分子之间存在
(3)在C分子中,Y原子的杂化方式为
(4)NaCl的晶体结构如图(2)所示,若将晶胞面心和体心的原子除去,顶点的钠离子换为Xn+(X代表某元素符号)离子,棱上的Cl-换为O2-,就得到X的氧化物的晶体结构.则该X的氧化物的化学式为
查看习题详情和答案>>
一个B分子中含有的Z原子个数比C分子中少1个,B、C两种分子中的电子数均等于10.请回答下列问题:
(1)X元素在周期表中的位置是
二
二
周期VIA
VIA
族.(2)分析同主族元素性质的递变规律,发现B、C物质沸点反常,这是因为它们的分子之间存在
氢键
氢键
.(3)在C分子中,Y原子的杂化方式为
sp3
sp3
,与Y原子同主族在第四周期的元素原子基态电子排布式是[Ar]4s24p3
[Ar]4s24p3
.(4)NaCl的晶体结构如图(2)所示,若将晶胞面心和体心的原子除去,顶点的钠离子换为Xn+(X代表某元素符号)离子,棱上的Cl-换为O2-,就得到X的氧化物的晶体结构.则该X的氧化物的化学式为
XO3
XO3
.
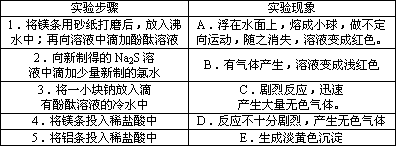
(18分)[探究实验一] 某同学探究同周期主族元素性质递变规律时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验方案”与“实验现象”前后不一定是对应关系):
| 实验步骤 | 实验现象 | ||||
| 1.将镁条用砂纸打磨后,放入沸水中;再向溶液中滴加酚酞溶液 |
| ||||
| 5.将铝条投入稀盐酸中 | E.生成淡黄色沉淀 |
(1)实验目的:探究同周期主族元素性质递变规律。
(2)实验用品:试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液。仪器:① ,② ,③ ,试管夹,镊子,小刀,玻璃片,砂纸,酒精灯等。
(3)实验内容:(填写与实验步骤对应的实验现象的编号和离子方程式)
| 实验内容 | 实验现象 | 离子方程式 |
| 1 | | |
| 2 | | |
| 3 | | |
| 4 | | |
| 5 | | |
;
(5)实验结论: ;
[探究实验二] 一定条件下,氯化镁与四氯化钛的混合物可作烯烃聚合反应
的催化剂。为了探究温度、氯化镁固体的含水量以及粉碎方式对该催化剂催化
效果的影响,设计如下对比实验:
| 实验 序号 | 氯化镁固体中氯元素含量/% | 温度/℃ | 粉碎方式/ | 催化效果/g·g-1 |
| 1 | 70.97 | 20 | 滚动球磨 | 3.9×104 |
 2 2 | 74.45 | 20 | 滚动球磨 | 5.0×104 |
| 3 | 74.45 | 20 | 振动球磨 | 5.9×104 |
| 4 | 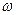 | 100 | 振动球磨 | |
(6)表中
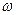 = ;
= ;(7)从实验1、2可以得出的结论是: ;
(8)设计实验2、3的目的是: 。 查看习题详情和答案>>
(18分)[探究实验一] 某同学探究同周期主族元素性质递变规律时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验方案”与“实验现象”前后不一定是对应关系):
请你帮助该同学整理并完成实验报告。
(1)实验目的:探究同周期主族元素性质递变规律。
(2)实验用品:试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液。仪器:① ,② ,③ ,试管夹,镊子,小刀,玻璃片,砂纸,酒精灯等。
(3)实验内容:(填写与实验步骤对应的实验现象的编号和离子方程式)
(4)若用最高价氧化物的水化物的碱性相对强弱来验证Mg、Al失电子能力的强弱,请你设计实验(实验用品自选,不要求写化学方程式):
;
(5)实验结论: ;
[探究实验二] 一定条件下,氯化镁与四氯化钛的混合物可作烯烃聚合反应
的催化剂。为了探究温度、氯化镁固体的含水量以及粉碎方式对该催化剂催化
效果的影响,设计如下对比实验:
(注:催化效果用单位时间内每克催化剂得到产品的质量来表示)
(6)表中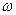 = ;
= ;
(7)从实验1、2可以得出的结论是: ;
(8)设计实验2、3的目的是: 。
| 实验步骤 | 实验现象 | ||||
| 1.将镁条用砂纸打磨后,放入沸水中;再向溶液中滴加酚酞溶液 |
| ||||
| 5.将铝条投入稀盐酸中 | E.生成淡黄色沉淀 |
(1)实验目的:探究同周期主族元素性质递变规律。
(2)实验用品:试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液。仪器:① ,② ,③ ,试管夹,镊子,小刀,玻璃片,砂纸,酒精灯等。
(3)实验内容:(填写与实验步骤对应的实验现象的编号和离子方程式)
| 实验内容 | 实验现象 | 离子方程式 |
| 1 | | |
| 2 | | |
| 3 | | |
| 4 | | |
| 5 | | |
;
(5)实验结论: ;
[探究实验二] 一定条件下,氯化镁与四氯化钛的混合物可作烯烃聚合反应
的催化剂。为了探究温度、氯化镁固体的含水量以及粉碎方式对该催化剂催化
效果的影响,设计如下对比实验:
| 实验 序号 | 氯化镁固体中氯元素含量/% | 温度/℃ | 粉碎方式/ | 催化效果/g·g-1 |
| 1 | 70.97 | 20 | 滚动球磨 | 3.9×104 |
 2 2 | 74.45 | 20 | 滚动球磨 | 5.0×104 |
| 3 | 74.45 | 20 | 振动球磨 | 5.9×104 |
| 4 | 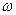 | 100 | 振动球磨 | |
(6)表中
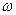 = ;
= ;(7)从实验1、2可以得出的结论是: ;
(8)设计实验2、3的目的是: 。
[探究实验一]:某同学探究同周期主族元素性质递变规律时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验方案”与“实验现象”前后不一定是对应关系):
请你帮助该同学整理并完成实验报告.
(1)实验目的:探究同周期主族元素性质递变规律.
(2)实验用品:试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液.仪器:①________,②________,③________,试管夹,镊子,小刀,玻璃片,砂纸,酒精灯等.
(3)实验内容:(填写与实验步骤对应的实验现象的编号和离子方程式)

(4)若用最高价氧化物的水化物的碱性相对强弱来验证Mg、Al失电子能力的
强弱,请你设计实验(实验用品自选,不要求写化学方程式):________;
(5)实验结论:________;
[探究实验二]:一定条件下,氯化镁与四氯化钛的混合物可作烯烃聚合反应的催化剂.为了探究温度、氯化镁固体的含水量以及粉碎方式对该催化剂催化效果的影响,设计如下对比实验:
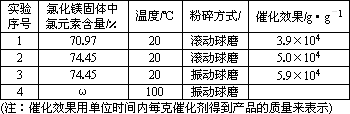
(6)表中ω=________;
(7)从实验1、2可以得出的结论是:________;
(8)设计实验2、3的目的是:________.
(2012?信阳二模)据元素周期表及周期律的知识回答下列问题:
(1)金属钠在一定条件下可与氢气反应生成氢化钠(2Na+H2
2NaH).生成物氢化钠的电子式为
 ,含有的化学键类型为
,含有的化学键类型为
(2)元素周期表中元素的性质存在递变规律,下列比较正确的是
a.离子半径:Na+>Mg2+>S2->Cl-b.酸性:H4SiO4>H3PO4>H2SO4>HClO4
c.氢化物稳定性:PH3<H2S<HCl d.与NaOH溶液反应的剧烈程度:Na>Mg>Al
(3)共价键的极性随共用电子对偏移程度的增大而增强,SiH4、PH3、H2S、HCl共价键的极性由强到弱的顺序是
(4)元素Cl与S元素相比,非金属性较强的是
a.常温下S比Cl2单质的熔点高 b.Cl2与S的氢化物发生反应,产生S单质
c.S与Cl2形成的化合物中S元素呈正价态 d.比较两元素的单质与H2化合时得电子的数目
(5)HF比HCl沸点高,原因是
(6)下表为部分非金属元素与氢形成共价键的键长与键能数据:根据表中数据,归纳共价键键能与键长的关系
查看习题详情和答案>>
(1)金属钠在一定条件下可与氢气反应生成氢化钠(2Na+H2
| 一定条件 |


离子键
离子键
键(填“离子”、“共价”或“金属”).(2)元素周期表中元素的性质存在递变规律,下列比较正确的是
c
c
.a.离子半径:Na+>Mg2+>S2->Cl-b.酸性:H4SiO4>H3PO4>H2SO4>HClO4
c.氢化物稳定性:PH3<H2S<HCl d.与NaOH溶液反应的剧烈程度:Na>Mg>Al
(3)共价键的极性随共用电子对偏移程度的增大而增强,SiH4、PH3、H2S、HCl共价键的极性由强到弱的顺序是
HCl>H2S>PH3>SiH4
HCl>H2S>PH3>SiH4
.(4)元素Cl与S元素相比,非金属性较强的是
Cl
Cl
(用元素符号表示),下列表述中能证明这一事实的是bc
bc
.a.常温下S比Cl2单质的熔点高 b.Cl2与S的氢化物发生反应,产生S单质
c.S与Cl2形成的化合物中S元素呈正价态 d.比较两元素的单质与H2化合时得电子的数目
(5)HF比HCl沸点高,原因是
HF分子之间存在氢键
HF分子之间存在氢键
.(6)下表为部分非金属元素与氢形成共价键的键长与键能数据:根据表中数据,归纳共价键键能与键长的关系
同主族元素原子与相同其他原子形成的共价键,键长越小,键能越大
同主族元素原子与相同其他原子形成的共价键,键长越小,键能越大
| 共价键 | H-H | H-F | H-Cl | H-Br | H-O | H-S | H-N | H-P |
| 键长(pm) | 74 | 92 | 127 | 141 | 98 | 135 | 101 | 341 |
| 键能(kJ/mol) | 436 | 568 | 432 | 368 | 464 | 364 | 391 | 142 |
 ,熔成小球,做不定向运动,随之消失,溶液变成红色。
,熔成小球,做不定向运动,随之消失,溶液变成红色。 ,熔成小球,做不定向运动,随之消失,溶液变成红色。
,熔成小球,做不定向运动,随之消失,溶液变成红色。