摘要:H2(g)+12O2(g)==H2O(l) ΔH=-285.8 kJ·mol-1 第二课时 燃料燃烧释放的热量 巩固练习
网址:http://m.1010jiajiao.com/timu3_id_193071[举报]
Ⅰ.氢气是一种清洁能源.
(1)已知 2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol;2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol
①表示氢气燃烧热的热化学方程式是
②燃烧2g H2生成水蒸气,放出的热量为
(2)人们可以通过多种途径获取氢气.14g CO与适量水蒸气反应生成CO2和H2,需放出20.5kJ热量,此反应的热化学方程式为
Ⅱ.煤是化石燃料.煤燃烧的反应热可通过以下两个途径来利用:a.利用煤在充足的空气中直接燃烧产生的反应热;b.先使煤与水蒸气反应得到氢气和一氧化碳,然后是使得到的氢气和一氧化碳在充足的空气中燃烧.这两个过程的化学方程式为:
a.C(s)+O2(g)=CO2(g)△H=E1 ①
b.C(s)+H2O(g)=CO(g)+H2(g)△H=E2 ②
H2(g)+
O2(g)=H2O(g)△H=E3 ③
CO(g)+
O2(g)=CO2(g)△H=E4 ④
请回答:(1)上述四个热化学方程式中哪个反应△H>0?
(2)等质量的煤分别通过以上两条不同的途径产生的可利用的总能量关系正确的是
A.a比b多 B. a比b少 C.a与b在理论上相同
Ⅲ.已知:N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ/mol
H2(g)+Cl2(g)═2HCl(g)△H=-184.6kJ/mol
N2(g)+2H2(g)+
Cl2(g)═NH4Cl(s)△H=-313.6kJ/mol
计算NH3(g)+HCl(g)═NH4Cl(s)的反应焓变:△H=
查看习题详情和答案>>
(1)已知 2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol;2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol
①表示氢气燃烧热的热化学方程式是
H2+
O2=H2O(l)△H=-285.8kJ/mol
| 1 |
| 2 |
H2+
O2=H2O(l)△H=-285.8kJ/mol
| 1 |
| 2 |
②燃烧2g H2生成水蒸气,放出的热量为
241.8
241.8
kJ.(2)人们可以通过多种途径获取氢气.14g CO与适量水蒸气反应生成CO2和H2,需放出20.5kJ热量,此反应的热化学方程式为
CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41kJ/mol
CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41kJ/mol
.Ⅱ.煤是化石燃料.煤燃烧的反应热可通过以下两个途径来利用:a.利用煤在充足的空气中直接燃烧产生的反应热;b.先使煤与水蒸气反应得到氢气和一氧化碳,然后是使得到的氢气和一氧化碳在充足的空气中燃烧.这两个过程的化学方程式为:
a.C(s)+O2(g)=CO2(g)△H=E1 ①
b.C(s)+H2O(g)=CO(g)+H2(g)△H=E2 ②
H2(g)+
| 1 |
| 2 |
CO(g)+
| 1 |
| 2 |
请回答:(1)上述四个热化学方程式中哪个反应△H>0?
②
②
(填序号)(2)等质量的煤分别通过以上两条不同的途径产生的可利用的总能量关系正确的是
C
C
. A.a比b多 B. a比b少 C.a与b在理论上相同
Ⅲ.已知:N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ/mol
H2(g)+Cl2(g)═2HCl(g)△H=-184.6kJ/mol
| 1 |
| 2 |
| 1 |
| 2 |
计算NH3(g)+HCl(g)═NH4Cl(s)的反应焓变:△H=
-175.1kJ/mol
-175.1kJ/mol
.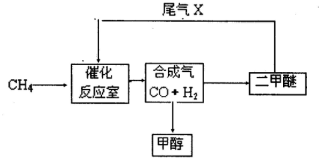 (2010?合肥三模)合成气(CO+H2)是一种重要的化工原料,在化工生产中具有十分广泛的用途. 可以生产被称为21世纪的新型燃料--甲醇、二甲醚(CH3OCH3)等物质.其工艺流程如下:
(2010?合肥三模)合成气(CO+H2)是一种重要的化工原料,在化工生产中具有十分广泛的用途. 可以生产被称为21世纪的新型燃料--甲醇、二甲醚(CH3OCH3)等物质.其工艺流程如下:(1)写出用合成气生产二甲醚的化学方程式
2CO+4H2
CH3OCH3+H2O
| ||
2CO+4H2
CH3OCH3+H2O
.
| ||
(2)尾气循环中涉及到以下反应:CH4(g)+H2O(g)?CO(g)+3H2(g),请写出某温度下该反应的平衡常数表达式
K=
| c(CO)?c3(H2) |
| c(H2O)?c(CH4) |
K=
.| c(CO)?c3(H2) |
| c(H2O)?c(CH4) |
(3)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)?CH3OH(g)△H1
反应Ⅱ:CO2(g)+3H2(g)?CH3(g)+H2O(g)△H2
①下表所列数据是反应在不同温度下的化学平衡常数(K).
| 温度 | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
<
<
0(填“>”、“=”、“<”).②已和:CH3OH(g)+
| 1 |
| 2 |
H2(g)+
| 1 |
| 2 |
则△H2=
-48.9kJ?mol-1
-48.9kJ?mol-1
.(4)以二甲醚、空气、氢氧化钾溶液为原料,铂为电极构成燃料电池.写出该电池负极的电极反应式
CH3OCH3+160H--12e-═2CO32-+11H2O
CH3OCH3+160H--12e-═2CO32-+11H2O
. 化学科学的重要责任在于认识自然界里存在的各种各样的、奇妙的化学反应,探索纷繁的化学反应的本质和规律.通过化学反应原理模块的学习,我们可以比较深刻地理解化学科学的精髓,提高化学学科素养.请根据所学化学反应原理,解决以下问题.
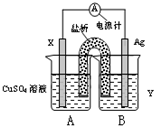
化学科学的重要责任在于认识自然界里存在的各种各样的、奇妙的化学反应,探索纷繁的化学反应的本质和规律.通过化学反应原理模块的学习,我们可以比较深刻地理解化学科学的精髓,提高化学学科素养.请根据所学化学反应原理,解决以下问题.(1)依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s) 设计的双液原电池,可以提供稳定的电流.装置如图所示,其中盐桥中装有琼脂-饱和KCl溶液.
回答下列问题:
①电极X的材料和电解质溶液Y分别为
Cu
Cu
、AgNO3溶液
AgNO3溶液
;②盐桥中K+移向
B
B
(填A或B);③银电极发生的电极反应为
Ag++e-=Ag
Ag++e-=Ag
.(2)已知:C(s)+O2(g)=CO2(g)△H1=-396.5kJ?mol-1
H2(g)+
| 1 |
| 2 |
CO(g)+
| 1 |
| 2 |
根据盖斯定律写出单质碳和水蒸气生成水煤气的热化学方程式:
C(s)+H2O(g)=CO(g)+H2(g)△H=128.3 kJ?mol-1
C(s)+H2O(g)=CO(g)+H2(g)△H=128.3 kJ?mol-1
.(3)100mL 1.0mol?L-1盐酸与100mL1.0mol?L-1NaOH溶液在量热计中进行中和反应.测得反应后溶液温度升高了6.8℃,已知稀溶液的比热容为4.2kJ/℃?kg-1,则该中和反应的反应热为
57.1 kJ?mol-1
57.1 kJ?mol-1
.(小数点后面保留一位有效数字)