摘要: 灼烧绿矾的反应方程式如下: 强热 2(FeSO4·7H2O)==Fe2O3+SO2↑+SO3↑+14H2O 将生成的气体通入BaCl2溶液中.下列叙述中正确的是( ) A.有BaSO4生成 B.有BaSO3生成 C.同时有BaSO4和BaSO3生成 D.有SO3逸出
网址:http://m.1010jiajiao.com/timu3_id_192486[举报]
 绿矾是一种重要的化工原料.
绿矾是一种重要的化工原料.【问题1】绿矾晶体(FeSO4?7H2O)由于保存不妥或长久放置,容易被空气中的氧气氧化而变质.为探究绿矾样品的变质情况,化学兴趣小组的同学设计了下列实验方案.可供选择的试剂:KSCN溶液、酸性KMnO4溶液、氯水、NaOH溶液、BaCl2溶液请参与完成方案设计.
实验准备:取少量绿矾样品,用蒸馏水在烧杯中配成溶液.
(1)方案1:取少量溶液,加入几滴
(2)方案2:取少量溶液,加入几滴酸性KMnO4溶液,如果观察到的现象是
(3)使用FeSO4时,如要防止Fe3+的干扰,可以加入适量铁粉进行除杂,写出加入铁粉后发生反应的离子方程式
【问题2】灼烧绿矾的反应方程式:2(FeSO4?7H2O)
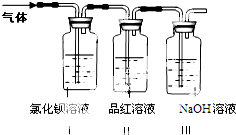
| ||
(1)装置Ⅰ中氯化钡溶液中可观察到现象
(2)装置Ⅱ中试剂为品红溶液,其作用是
(3)装置Ⅲ中试剂为NaOH溶液,其目的是
灼烧绿矾的反应方程式如下:

将生成的气体通入BaCl2溶液中,下列叙述中正确的是
A.有BaSO4生成 B.有BaSO3生成
C.同时有BaSO4和BaSO3生成 D.有SO3逸出
查看习题详情和答案>>
灼烧绿矾的反应方程式如下:
2(FeSO4·7H2O) Fe2O3+SO2↑+
SO3↑+ 14H2O
Fe2O3+SO2↑+
SO3↑+ 14H2O
将生成的气体通入BaCl2溶液中,下列叙述中正确的是( )
A.有BaSO4生成 B.有BaSO3生成
C.同时有BaSO4和BaSO3生成 D.有SO3逸出
查看习题详情和答案>>
