题目内容
 绿矾是一种重要的化工原料.
绿矾是一种重要的化工原料.【问题1】绿矾晶体(FeSO4?7H2O)由于保存不妥或长久放置,容易被空气中的氧气氧化而变质.为探究绿矾样品的变质情况,化学兴趣小组的同学设计了下列实验方案.可供选择的试剂:KSCN溶液、酸性KMnO4溶液、氯水、NaOH溶液、BaCl2溶液请参与完成方案设计.
实验准备:取少量绿矾样品,用蒸馏水在烧杯中配成溶液.
(1)方案1:取少量溶液,加入几滴
(2)方案2:取少量溶液,加入几滴酸性KMnO4溶液,如果观察到的现象是
(3)使用FeSO4时,如要防止Fe3+的干扰,可以加入适量铁粉进行除杂,写出加入铁粉后发生反应的离子方程式
【问题2】灼烧绿矾的反应方程式:2(FeSO4?7H2O)
| ||
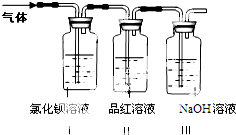
(1)装置Ⅰ中氯化钡溶液中可观察到现象
(2)装置Ⅱ中试剂为品红溶液,其作用是
(3)装置Ⅲ中试剂为NaOH溶液,其目的是
分析:【问题1】绿矾样品被氧化会生成Fe3+,Fe3+可使KSCN溶液会变血红色,Fe2+能使酸性KMnO4溶液褪色,Fe3+与Fe反应生成Fe2+以此分析;
【问题2】氯化钡溶液用于检验产物SO3,品红溶液用于检验产物SO2,氢氧化钠溶液用于尾气吸收.
【问题2】氯化钡溶液用于检验产物SO3,品红溶液用于检验产物SO2,氢氧化钠溶液用于尾气吸收.
解答:解:【问题1】(1)绿矾样品被氧化会生成Fe3+,有Fe3+存在即可明绿矾样品已被氧化,Fe3+可使KSCN溶液会变血红色,
故答案为:KSCN溶液;
(2)Fe2+能使酸性KMnO4溶液褪色,若溶液不褪色,说明溶液中没有Fe2+,则证明绿矾样品完全被氧化,
故答案为:溶液不褪色;
(3)Fe3+与Fe反应生成Fe2+,离子方程式为:2Fe3++Fe=3Fe2+,故答案为:2Fe3++Fe=3Fe2+;
【问题2】(1)氯化钡溶液用于检验产物SO3,SO3+H2O=H2SO4,硫酸与氯化钡反应生成硫酸钡白色沉淀,装置Ⅰ中氯化钡溶液中可观察到有白色沉淀产生,
故答案为:有白色沉淀产生; (2)SO2具有漂白性,可以使品红溶液褪色,因此品红溶液用于检验产物SO2,
故答案为:检验产生的气体中是否含SO2;品红溶液褪色;
(3)氢氧化钠溶液用于吸收多余的SO2,防止造成空气污染,
故答案为:除去多余的SO2,防止污染空气.
故答案为:KSCN溶液;
(2)Fe2+能使酸性KMnO4溶液褪色,若溶液不褪色,说明溶液中没有Fe2+,则证明绿矾样品完全被氧化,
故答案为:溶液不褪色;
(3)Fe3+与Fe反应生成Fe2+,离子方程式为:2Fe3++Fe=3Fe2+,故答案为:2Fe3++Fe=3Fe2+;
【问题2】(1)氯化钡溶液用于检验产物SO3,SO3+H2O=H2SO4,硫酸与氯化钡反应生成硫酸钡白色沉淀,装置Ⅰ中氯化钡溶液中可观察到有白色沉淀产生,
故答案为:有白色沉淀产生; (2)SO2具有漂白性,可以使品红溶液褪色,因此品红溶液用于检验产物SO2,
故答案为:检验产生的气体中是否含SO2;品红溶液褪色;
(3)氢氧化钠溶液用于吸收多余的SO2,防止造成空气污染,
故答案为:除去多余的SO2,防止污染空气.
点评:本题考查了重要离子和常见化合物的检验,所有的实验药品、实验步骤、实验现象、实验装置均取决于实验原理,因此掌握物质的性质及检测原理是解题的关键.

练习册系列答案
相关题目
 绿矾(FeSO4?7H2O)是重要的化学化工试剂,工业上常利用机械加工行业产生的废铁屑为原料制备.
绿矾(FeSO4?7H2O)是重要的化学化工试剂,工业上常利用机械加工行业产生的废铁屑为原料制备.请回答下列问题:
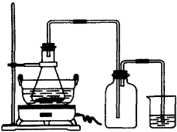
(1)图是某研究性学习小组用于制备绿矾的装置,其中集气瓶的作用是
(2)如图锥形瓶中的反应物是铁屑和28%的硫酸,反应前常用98%的硫酸配制500g 28%的硫酸,要算出所需98%的硫酸的体积,还要知道的数据是
(3)在制备硫酸亚铁的过程中,理论上控制铁过量或酸过量均有利于防止Fe2+被氧化.设计两个实验:实验一,控制酸过量;实验二,控制铁过量;其余步骤同,制得硫酸亚铁,并对产品质量进行检测.检测结果如下:
| 序号 | 反应物用量 | 产品质量 |
| 1 | n(H2SO4):n(Fe)>1:1 | 介于Ⅰ级~Ⅱ级之间 |
| 2 | n(H2SO4):n(Fe)<1:1 | 优于Ⅰ级 |
(4)该小组在继续研究由绿矾制备Fe(OH)2的过程中,发现出现白色的沉淀会逐渐转变为灰绿色,最后变为红褐色.甲同学查资料该灰绿色沉淀可能是Fe3(OH)8,请用氧化物的形式写出该沉淀
绿矾是重要的化学化工试剂,工业上常利用机械加工行业产生的废铁屑为原料制备.请回答下列问题:
(1)右图锥形瓶中的反应物是铁屑和28%的硫酸,反应前常用98%的硫酸配制500g 28%的硫酸,要算出所需98%的硫酸的体积,还要知道的数据是______.
(2)在制备硫酸亚铁的过程中,理论上控制铁过量或酸过量均有利于防止Fe2+被氧化.设计两个实验:实验一,控制酸过量;实验二,控制铁过量;其余步骤同,制得硫酸亚铁,并对产品质量进行检测.检测结果如下:
已知产品质量标准:Fe3+的质量分数等于0.005%,产品质量定为Ⅰ级;Fe3+的质量分数等于0.01%,产品质量定为Ⅱ级,从实验结果中,可得出制备硫酸亚铁溶液时,反应控制______过量为最佳.
(3)该小组在继续研究由绿矾制备Fe(OH)2的过程中,发现出现白色的沉淀会逐渐转变为灰绿色,最后变为红褐色.甲同学查资料该灰绿色沉淀可能是Fe3(OH)8,请用氧化物的形式写出该沉淀______;乙同学查资料后认为该灰绿色沉淀是由于Fe(OH)2部分被氧化,混入少量的Fe(OH)3的缘故,请提出一种在研究由Fe2+制备Fe(OH)2的过程中,有助于对沉淀由“白”变“绿”的现象进行合理解释的实验设计新思路______.

(1)右图锥形瓶中的反应物是铁屑和28%的硫酸,反应前常用98%的硫酸配制500g 28%的硫酸,要算出所需98%的硫酸的体积,还要知道的数据是______.
(2)在制备硫酸亚铁的过程中,理论上控制铁过量或酸过量均有利于防止Fe2+被氧化.设计两个实验:实验一,控制酸过量;实验二,控制铁过量;其余步骤同,制得硫酸亚铁,并对产品质量进行检测.检测结果如下:
| 序号 | 反应物用量 | 产品质量 |
| 1 | n(H2SO4):n(Fe)>1:1 | 介于Ⅰ级~Ⅱ级之间 |
| 2 | n(H2SO4):n(Fe)<1:1 | 优于Ⅰ级 |
(3)该小组在继续研究由绿矾制备Fe(OH)2的过程中,发现出现白色的沉淀会逐渐转变为灰绿色,最后变为红褐色.甲同学查资料该灰绿色沉淀可能是Fe3(OH)8,请用氧化物的形式写出该沉淀______;乙同学查资料后认为该灰绿色沉淀是由于Fe(OH)2部分被氧化,混入少量的Fe(OH)3的缘故,请提出一种在研究由Fe2+制备Fe(OH)2的过程中,有助于对沉淀由“白”变“绿”的现象进行合理解释的实验设计新思路______.

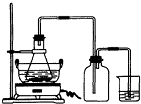 (2009?广东模拟)绿矾(FeSO4?7H2O)是重要的化学化工试剂,工业上常利用机械加工行业产生的废铁屑为原料制备.请回答下列问题:
(2009?广东模拟)绿矾(FeSO4?7H2O)是重要的化学化工试剂,工业上常利用机械加工行业产生的废铁屑为原料制备.请回答下列问题: