网址:http://m.1010jiajiao.com/timu3_id_192037[举报]
| 方案 | 操作 | 结论 |
| 甲 | 分别加入到盛水的试管中 | 放热者为浓硫酸 |
| 乙 | ||
| 丙 | ||
| 丁 |
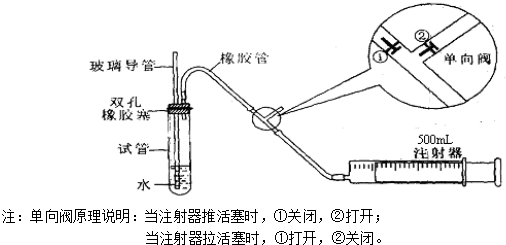
甲同学是用手捂住试管(或微热试管),观察导管中是否有液面上升的现象.是否能?
乙同学是先从玻璃导管向试管中注入水,观察导管中液面与试管中液面是否形成高度差,且在一段时间后,观察液面差是否变化的方法.是否能?
若上述两种方案均不能,请思考新方案,并填下列空白(若上述可行,则不填下列空白):先在试管中装入适量水(保证玻璃导管的下端浸没在水中),然后(填操作方法)
(2)向试管中加入0.00127%的碘水10g,用适量的蒸馏水稀释后,再加入2~3滴淀粉溶液,配置成溶液A.测定指定地点空气中SO2的含量时,推拉注射器的活塞反复抽气,试管中发生的化学反应方程式为SO2+I2+2H2O=H2SO4+2HI,A溶液由
(3)我国环境空气质量标准中对每次空气质量测定中SO2的最高浓度限值(mg/m3):一级标准:0.15;二级标准:0.50;三级标准:0.70.该课外活动小组分成第一活动小组和第二活动小组,使用相同的实验装置和溶液A,在同一地点、同时测量空气中SO2的含量.当反应恰好完全进行,记录抽气时间和次数如下(假定每次抽气500mL).请将下表填写完整(计算时保留2位有效数字):
| 分组 | 第一小组 | 第二小组 |
| 抽气时间 | 20分钟 | 21分钟 |
| 抽气次数 | 100 | 130 |
| SO2含量mg/m3 |
②判断该地点的空气中SO2含量属于
【提出猜想】同学们对溶液中Fe3+和![]() 之间的反应进行了猜想,提出了如下观点:
之间的反应进行了猜想,提出了如下观点:
Ⅰ、认为发生相互促进的水解反应,其离子反应方程式为:
2Fe3++3![]() +6H2O
+6H2O![]() 2Fe(OH)3(胶体)+3H2SO3
2Fe(OH)3(胶体)+3H2SO3
Ⅱ、认为发生氧化还原反应,其离子反应方程式为:
2Fe3++![]() +H2O
+H2O![]() 2Fe2++2H++
2Fe2++2H++![]()
【实验验证】为验证“猜想”,同学们实验如下:
(1)取一定量的Na2SO3固体配成Na2SO3浓溶液。
(2)取5 mL FeCl3浓溶液于试管中,逐滴加入Na2SO3浓溶液,溶液颜色先由黄色变为红棕色,但无气泡产生,无沉淀生成;继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变成红褐色溶液。
(3)换用稀释的FeCl3和Na2SO3溶液重复上述实验,产生的现象完全相同。
(4)为判断红褐色溶液中含有Fe(OH)3从而证明猜想Ⅰ正确。①部分同学认为只要证明该体系为胶体即可,因此通过_____________现象设计实验方案,证明了其为Fe(OH)3胶体;
②部分同学从反证法的角度考虑,认为只要证明红褐色溶液中仍然有+3价的铁,可说明Fe3+没有被还原为Fe2+则猜想Ⅱ不正确,设计方案为,观察到,从而说明红褐色溶液中含有+3价的铁。
(5)另有部分同学认为只要证明红褐色溶液中含有![]() 可判断猜想Ⅱ正确,因此设计方案为_____________,观察到有白色沉淀生成_____________。
可判断猜想Ⅱ正确,因此设计方案为_____________,观察到有白色沉淀生成_____________。
【解释结论】综合(4)(5)考虑,Fe3+与![]() 的反应类型为_____________。
的反应类型为_____________。
【实验反思】某学同认为(5)中![]() 来源不一定是被Fe3+氧化得到的,因此不能推断猜想Ⅱ正确。你是否赞成该同学的观点_____________(填“是”或“否”)。如果赞成,你对实验改进的建议_____________(如果不赞成,该问不必作答)。
来源不一定是被Fe3+氧化得到的,因此不能推断猜想Ⅱ正确。你是否赞成该同学的观点_____________(填“是”或“否”)。如果赞成,你对实验改进的建议_____________(如果不赞成,该问不必作答)。
【拓展探究】鉴于Na2CO3在组成上与Na2SO3相似,某同学在FeCl3溶液中加入Na2CO3溶液,马上观察到红褐色沉淀并且产生无色气体,该反应的离子方程式是_____________;同学们交流后认为二者水溶液与氯化铁溶液反应的现象差别很大,除![]() 有较强的还原性而
有较强的还原性而![]() 没有还原性的原因外,还可能有的原因是__________________________。
没有还原性的原因外,还可能有的原因是__________________________。
环节一:理论推测
部分同学认为Br2和I2都可能将Fe2+氧化为Fe3+,他们思考的依据是
部分同学认为Br2和I2都不能将Fe2+氧化为Fe3+,还有同学认为Br2能将Fe2+氧化为Fe3+而I2不能.他们思考的依据是从上到下卤素单质氧化性减弱.
环节二:设计实验进行验证
在大试管中加适量铁粉,加入10mL 稀盐酸,振荡试管,充分反应后,铁粉有剩余,取上层清液进行下列实验.
实验1:
| 试管 | 操作 | 现象 |
| ① | 先向试管中加入2mL FeCl2溶液,再滴加少量红棕色的溴水,振荡试管 | 溶液为黄色 |
| ② | 先向试管中加入2mL FeCl2溶液,再滴加少量棕黄色的碘水,振荡试管 | 溶液为黄色 |
(1)同学甲认为①中现象说明溴水能将Fe2+氧化,离子方程式为
同学乙认为应该补充实验,才能得出同学甲的结论.请你帮助同学乙完成实验:
实验2:
| 操作 | 应该观察到的现象 |
可能1:碘水与FeCl2溶液不反应,黄色是碘水稀释后的颜色.
可能2:
实验3:进行实验以确定可能的原因.
| 操作 | 现象 |
| 向试管②所得溶液中继续加入0.5mLCCl4,充分振荡,静置一段时间后.取出上层溶液,滴加KSCN 溶液 | 静置后,上层溶液几乎无色,下层溶液为紫色;上层溶液滴加KSCN 溶液后,出现浅红色 |
实验4:
| 操作 | 现象 |
| 向另一支试管中加入2mL FeCl2溶液,滴加0.5mL碘水后,再加入0.5mL 乙酸乙酯,充分振荡,静置一段时间后.取出下层溶液,滴加KSCN 溶液 | 静置后,上层液为紫色,下层液几乎无色;下层溶液滴加KSCN溶液后,没有出现浅红色 |
同学丁根据实验4现象得出结论:在本次实验条件下,碘水与FeCl2溶液反应的程度很小.
(3)Cl2、Br2、I2氧化Fe2+ 的能力逐渐减弱,用原子结构解释原因:
某化学小组在学习元素周期律后,对教材中Fe2+氧化为Fe3+的实验进一步思考,并提出问题:Cl2能将Fe2+氧化为Fe3+,那么Br2和I2能否将Fe2+氧化为Fe3+?
环节一:理论推测
部分同学认为Br2和I2都可能将Fe2+氧化为Fe3+,他们思考的依据是 。
部分同学认为Br2和I2都不能将Fe2+氧化为Fe3+,还有同学认为Br2能将Fe2+氧化为Fe3+而I2不能。他们思考的依据是从上到下卤素单质氧化性减弱。
环节二:设计实验进行验证
在大试管中加适量铁粉,加入10 mL 稀盐酸,振荡试管,充分反应后,铁粉有剩余,取上层清液进行下列实验。
实验1:
|
试管 |
操作 |
现象 |
|
① |
先向试管中加入2 mL FeCl2溶液,再滴加少量红棕色的溴水,振荡试管 |
溶液为黄色 |
|
② |
先向试管中加入2 mL FeCl2溶液,再滴加少量棕黄色的碘水,振荡试管 |
溶液为黄色 |
环节三:实验现象的分析与解释
(1)同学甲认为①中现象说明溴水能将Fe2+氧化,离子方程式为 。
同学乙认为应该补充实验,才能得出同学甲的结论。请你帮助同学乙完成实验:
实验2:
|
操作 |
应该观察到的现象 |
|
|
|
(2)该小组同学对②中溶液呈黄色的原因展开了讨论:
可能1:碘水与FeCl2溶液不反应,黄色是碘水稀释后的颜色。
可能2: 。
实验3:进行实验以确定可能的原因。
|
操作 |
现象 |
|
向试管②所得溶液中继续加入0.5 mLCCl4,充分振荡,静置一段时间后。取出上层溶液,滴加KSCN 溶液 |
静置后,上层溶液几乎无色,下层溶液为紫色;上层溶液滴加KSCN 溶液后,出现浅红色 |
同学丙认为该实验现象可以说明是“可能2”成立,同学丁认为不严谨,于是设计了实验4:
实验4:
|
操作 |
现象 |
|
向另一支试管中加入2 mL FeCl2溶液,滴加0.5mL碘水后,再加入0.5mL 乙酸乙酯,充分振荡,静置一段时间后。取出下层溶液,滴加KSCN 溶液 |
静置后,上层液为紫色,下层液几乎无色;下层溶液滴加KSCN溶液后,没有出现浅红色 |
你认为实验4设计的主要目的是 。
同学丁根据实验4现象得出结论:在本次实验条件下,碘水与FeCl2溶液反应的程度很小。
(3)Cl2、Br2、I2氧化Fe2+ 的能力逐渐减弱,用原子结构解释原因: 。
查看习题详情和答案>>