摘要:H2和CO的混合气体5.6L充分燃烧,需要O2的质量为 A.8g B.16g C.4g D.无法确定
网址:http://m.1010jiajiao.com/timu3_id_192018[举报]
将3.2克H2和CO的混合气体(其密度为相同条件下氧气密度的
),通入一盛有足量Na2O2密闭容器中,再通入过量O2,并用电火花点燃使其充分反应,最后容器中固体的质量增加了( )
| 1 |
| 2 |
| A、3.2g | B、4.4g |
| C、5.6g | D、6.4g |
标准状况下的H2和CO的混合气体总体积4.48L,其总质量为4.3g.
求:(1)混合气体的平均摩尔质量
(2)混合气体所含质子的总物质的量
(3)若该混合气体与氧气恰好完全反应,则消耗标准状况下O2
查看习题详情和答案>>
求:(1)混合气体的平均摩尔质量
21.5
21.5
g/mol;(2)混合气体所含质子的总物质的量
2.2
2.2
mol,(3)若该混合气体与氧气恰好完全反应,则消耗标准状况下O2
2.24
2.24
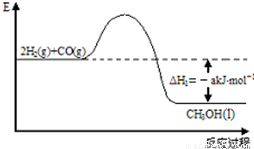
L. 能源是人类生存和发展的重要支柱.研究和有效地开发新能源在能源紧缺的今天具有重要的理论意义.已知H2与CO反应生成CH3OH的过程如图所示:CO的燃烧热△H2=-bkJ?mol-1,CH3OH的燃烧热△H3=-ckJ?mol-1.请根据以上信息,回答下列有关问题:
能源是人类生存和发展的重要支柱.研究和有效地开发新能源在能源紧缺的今天具有重要的理论意义.已知H2与CO反应生成CH3OH的过程如图所示:CO的燃烧热△H2=-bkJ?mol-1,CH3OH的燃烧热△H3=-ckJ?mol-1.请根据以上信息,回答下列有关问题:(1)CH3OH燃烧的热化学反应方程式为
2CH3OH(l)+3O2(g)→2CO2(g)+4H2O(l)△H=-2ckJ?mol-1
2CH3OH(l)+3O2(g)→2CO2(g)+4H2O(l)△H=-2ckJ?mol-1
.(2)H2的燃烧热为
| a+c-b |
| 2 |
| a+c-b |
| 2 |
(3)一些化学键键能如下:C≡O为d kJ/mol;O=O为ekJ/mol;C=O为fkJ/mol.则由以上数据有b=
2f-d-
| e |
| 2 |
2f-d-
(用d、e、f的代数式表示).| e |
| 2 |
(4)H2和CO的混合气体nmol,充分燃烧共放出QkJ热量,则混合气体中H2和CO的物质的量之比为
(2bn-2Q):(bn-an-cn+2Q)
(2bn-2Q):(bn-an-cn+2Q)
.(5)CO与O2可以组成新型燃料电池,若该电池以Pt为电极,以KOH为电解质溶液,写出该燃料电池的负极反应式
CO-2e-+4OH-=CO32-+2H2O
CO-2e-+4OH-=CO32-+2H2O
.将3.2克H2和CO的混合气体(其密度为相同条件下氧气密度的1/2),通入一盛有足量Na2O2密闭容器中,再通入过量O2,并用电火花点燃使其充分反应,最后容器中固体的质量增加了
A.3.2 g B.4.4 g C.5.6 g D.6.4 g
查看习题详情和答案>>
能源是人类生存和发展的重要支柱.研究和有效地开发新能源在能源紧缺的今天具有重要的理论意义.已知H2与CO反应生成CH3OH的过程如图所示:CO的燃烧热△H2=-bkJ?mol-1,CH3OH的燃烧热△H3=-ckJ?mol-1.请根据以上信息,回答下列有关问题:
(1)CH3OH燃烧的热化学反应方程式为______.
(2)H2的燃烧热为______.
(3)一些化学键键能如下:C≡O为d kJ/mol;O=O为ekJ/mol;C=O为fkJ/mol.则由以上数据有b=______(用d、e、f的代数式表示).
(4)H2和CO的混合气体nmol,充分燃烧共放出QkJ热量,则混合气体中H2和CO的物质的量之比为______.
(5)CO与O2可以组成新型燃料电池,若该电池以Pt为电极,以KOH为电解质溶液,写出该燃料电池的负极反应式______.
 查看习题详情和答案>>
查看习题详情和答案>>
(1)CH3OH燃烧的热化学反应方程式为______.
(2)H2的燃烧热为______.
(3)一些化学键键能如下:C≡O为d kJ/mol;O=O为ekJ/mol;C=O为fkJ/mol.则由以上数据有b=______(用d、e、f的代数式表示).
(4)H2和CO的混合气体nmol,充分燃烧共放出QkJ热量,则混合气体中H2和CO的物质的量之比为______.
(5)CO与O2可以组成新型燃料电池,若该电池以Pt为电极,以KOH为电解质溶液,写出该燃料电池的负极反应式______.
 查看习题详情和答案>>
查看习题详情和答案>>