网址:http://m.1010jiajiao.com/timu3_id_191709[举报]
I.已知有如下氧化还原反应:Zn+2HNO3+NH4NO3=N2↑+Zn(NO3)2+3H2O,则:
(1)该反应的还原剂为 ,还原产物为 。(写化学式)
(2)若产生的N2在标准状况下体积为2.24L,则反应中转移的电子数为 NA。
II.(6分)化学与我们的生活密切相关,请用化学方程式描述以下生活中的实例:
(1)盛有NaHCO3的干粉灭火器用于灭火
(2)铁质菜刀的“淬火”工艺:将红热的菜刀浸入水中急速冷却
(3)饲养金鱼用的自来水必须经过太阳暴晒后才能使用
查看习题详情和答案>>
I.已知有如下氧化还原反应:Zn+2HNO3+NH4NO3=N2↑+Zn(NO3)2+3H2O,则:
(1)该反应的还原剂为 ,还原产物为 。(写化学式)
(2)若产生的N2在标准状况下体积为2.24L,则反应中转移的电子数为 NA。
II.(6分)化学与我们的生活密切相关,请用化学方程式描述以下生活中的实例:
(1)盛有NaHCO3的干粉灭火器用于灭火
(2)铁质菜刀的“淬火”工艺:将红热的菜刀浸入水中急速冷却
(3)饲养金鱼用的自来水必须经过太阳暴晒后才能使用
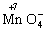 氧化为
氧化为(1)XY3的电子式为_________。
(2)X2Y4为可燃性无色液体,16gX2Y4在空气中完全燃烧可放出312kJ热量(生成物不污染环境,其中一种产物为液体),则反应的热化学方程式为__________________________________________。
(3)X2Y4在氧化还原反应中与过氧化氢相似,既可作氧化剂,又可作还原剂。请分析产生这种情况的原因:______________________________________。
(4)X2Y4的水溶液显______(填“酸”、“碱”或“中”)性,说明原因(用反应式表示):__________________
____________________________。 查看习题详情和答案>>
研究化学反应实质,探究反应规律,是提高我们化学素养的有效手段,其中“以强制弱”的规律是我们所熟知的。
(1)今有HA、H2B两种弱酸,有如下关系:H2B(少量)+A-=== HB-+HA ,则在A-、HB-、B2-离子中,最易结合质子的是 ;
(2)酸性强弱除了与物质本身属性有关外,还和溶剂有关,如CH3COOH与HF在液氨中受NH3影响可发生完全电离。那么在液氨中反应:CH3COONa + HCl == NaCl + CH3COOH 能否发生,为什么? ;
(3)铝铵矾,其主要化学成分为十二水硫酸铝铵,向该盐的溶液中逐滴加入NaOH溶液,产生的现象有:
①溶液中出现白色沉淀;
②有刺激性气味的气体放出;
③白色沉淀量逐渐增多;
④白色沉淀逐渐消失;
请排出以上各种现象由先到后出现的正确顺序(用序号回答) ;
(4)在氧化还原反应中,也有“以强制弱”的类似规律。已知MnO2在酸性溶液中易被还原成Mn2+, MnO2、Cl2、FeCl3、I2的氧化性依次减弱。下列反应在水溶液中不可能发生的是( )
A.3Cl2 + 6FeI2 = 2FeCl3 +4FeI3 B.Cl2 + FeI2=FeCl2 +I2
C.MnO2+4HCl = MnCl2 +Cl2↑+2H2O D.2Fe3++2I-= 2Fe2++I2
查看习题详情和答案>>