摘要:23.Ⅰ.下表是元素周期表的一部分.针对表中的①-⑧中元素.用元素符号或化学式填空回答. 主族 周期 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 零 二 ① ② 三 ③ ④ ⑤ ⑥ ⑦ ⑧ (1)单质硬度最大的元素是 , (2)元素的最高价氧化物对应的水化物中.具有两性的是 , (3)元素的气态氢化物中.最稳定的是 , (4)最高价氧化物对应的水化物中.酸性最强的是 , (5)元素③的最高价氧化物对应水化物和元素⑤的最高价氧化物对应水化物反应的离子方程式为 . Ⅱ.W.X.Y.Z.R五种元素都位于短周期内.它们的原子序数依次递增.W原子核内只有一个质子.X原子的电子总数与Z原子的最外层电子数相等.W原子与X原子的最外层电子数之和与Y原子的最外层电子数相等.Z原子的最外层电子数是次外层电子数的3倍.在短周期主族元素中.R元素的原子半径最大.回答下列有关问题: (1)X元素的原子结构示意图为 .Z元素在周期表中位于第 周期 族. (2)写出W和Y两元素的单质反应生成物质的电子式 . (3)用电子式表示R2Z的形成过程 . (4)已知W.X.Y.Z可组成一种化合物.其原子个数比为5:1:1:3.该化合物的化学式为 .属于 化合物.
网址:http://m.1010jiajiao.com/timu3_id_188029[举报]
下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
(1)元素⑩名称为
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是
 .
.
(3)用电子式表示元素④与⑥的化合物的形成过程:
 ,该化合物属于
,该化合物属于
(4)写出一种由上述元素组成的既有离子键又有非极性共价键的物质的化学式
(5)⑥、⑦、⑨三种元素形成的离子,离子半径由大到小的顺序是
查看习题详情和答案>>
| 主族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
溴
溴
在周期表中的位置第4周期第ⅦA族
第4周期第ⅦA族
.(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是
HClO4
HClO4
,碱性最强的化合物的电子式是:

(3)用电子式表示元素④与⑥的化合物的形成过程:


离子
离子
(填“共价”或“离子”)化合物.(4)写出一种由上述元素组成的既有离子键又有非极性共价键的物质的化学式
Na2O2或K2O2
Na2O2或K2O2
.(5)⑥、⑦、⑨三种元素形成的离子,离子半径由大到小的顺序是
S2->Cl->K+
S2->Cl->K+
(用离子符号表示).下表是元素周期表的一部分,针对表中的①~⑨种元素,用适当的化学用语填写下列空白:
(1)表中最活泼的金属元素是:
(2)可用于半导体材料的元素是:
第
(3)画出元素⑦的原子结构示意图:
 ,该元素与元素⑨组成的化合物的电子式是:
,该元素与元素⑨组成的化合物的电子式是:
 .
.
(4)在第3周期元素的最高价氧化物对应水化物中,酸性最强的是:
查看习题详情和答案>>
| 族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
K
K
.(填元素符号)(2)可用于半导体材料的元素是:
Si
Si
(填元素符号),它在元素周期表中的位置为第
3
3
周期ⅣA
ⅣA
族.(3)画出元素⑦的原子结构示意图:




(4)在第3周期元素的最高价氧化物对应水化物中,酸性最强的是:
HClO4
HClO4
(填化学式,下同);碱性最强的是:NaOH
NaOH
;具有两性的是Al(OH)3
Al(OH)3
,其与氢氧化钠溶液反应的离子方程式为:Al(OH)3+OH-═AlO2-+2H2O
Al(OH)3+OH-═AlO2-+2H2O
.下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白.
(1)在这些元素中化学性质最不活泼的是
(2)①②⑥⑦中原子半径最小的是
(3)表中氧化性最强的单质的化学式为
(4)这些元素的最高价氧化物的水化物中,碱性最强的是
(5)⑥⑦两种元素中,离子半径较小的是
(6)④⑧⑨三种元素的气态氢化物的稳定性强弱顺序为
(7)①与③形成的化合物中,固态时俗称干冰的结构式
(8)画出⑨的原子结构示意图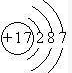
 .
.
(9)元素②的氢化物与元素⑨的氢化物反应的化学方程式为
查看习题详情和答案>>
| 主族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 | |
| 2 | ① | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | |||||
Ne
Ne
(填元素符号)(2)①②⑥⑦中原子半径最小的是
N
N
(填元素符号);(3)表中氧化性最强的单质的化学式为
F2
F2
;(4)这些元素的最高价氧化物的水化物中,碱性最强的是
NaOH
NaOH
(填化学式);(5)⑥⑦两种元素中,离子半径较小的是
Al3+
Al3+
(填离子符号);(6)④⑧⑨三种元素的气态氢化物的稳定性强弱顺序为
HF
HF
>HCl
HCl
>H2S
H2S
(填化学式);(7)①与③形成的化合物中,固态时俗称干冰的结构式
O=C=O
O=C=O
,该化合物属于共价
共价
(填“共价”或“离子”)化合物.(8)画出⑨的原子结构示意图


(9)元素②的氢化物与元素⑨的氢化物反应的化学方程式为
NH3+HCl═NH4Cl
NH3+HCl═NH4Cl
;该反应的产物属于离子
离子
(填“共价”或“离子”)化合物.下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼的是:
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是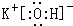
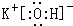 .
.
(3)最高价氧化物是两性氧化物的元素是
(4)用电子式表示元素④与⑥形成的化合物的形成过程: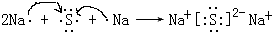
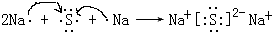 ,该化合物属于
,该化合物属于
查看习题详情和答案>>
| 主族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
Ar
Ar
(填具体元素符号,下同).(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是
HClO4
HClO4
,碱性最强的化合物的电子式是: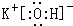
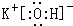
(3)最高价氧化物是两性氧化物的元素是
Al
Al
;写出它的氧化物与氢氧化钠反应的离子方程式Al2O3+2NaOH═2NaAlO2+H2O
Al2O3+2NaOH═2NaAlO2+H2O
.(4)用电子式表示元素④与⑥形成的化合物的形成过程:
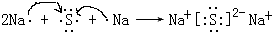
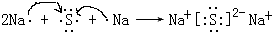
离子
离子
(填“共价”或“离子”)化合物.下表是元素周期表的一部分,针对表中的 ①~⑩中元素,用元素符号或化学式填空回答以下问题:
(1)在这些元素中,最易失电子的元素是
(2)化学性质最不活泼的元素的原子结构示意图为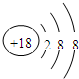
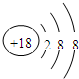
(3)元素的最高价氧化物对应的水化物中酸性最强的酸是
(4)在③~⑦元素中,原子半径最大的是
(5)在⑦与⑩的单质中,氧化性强的是
查看习题详情和答案>>
| 主族 周期 |
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
K
K
,非金属性最强的元素是F
F
(2)化学性质最不活泼的元素的原子结构示意图为
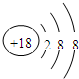
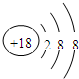
(3)元素的最高价氧化物对应的水化物中酸性最强的酸是
HClO4
HClO4
,碱性最强的碱是KOH
KOH
,呈两性的氢氧化物是Al(OH)3
Al(OH)3
;(4)在③~⑦元素中,原子半径最大的是
Na
Na
,原子半径最小的是Cl
Cl
;(5)在⑦与⑩的单质中,氧化性强的是
Cl2
Cl2
,可用什么化学反应说明该事实(写出反应的化学方程式):2NaBr+Cl2=2NaCl+Br2
2NaBr+Cl2=2NaCl+Br2
.