摘要:7.目前.世界上生产的镁有60%来自海水.海水提镁.最基本的方法就是往海水里加碱使镁沉淀出来.然后经过一系列处理.最终得到单质镁.试判断:在海水提镁的过程中.不可能发生的反应有 A.↑ B.↑ C.Mg(OH)2+2HCl==MgCl2+2H2O D.Mg2++2OH-==Mg(OH)2↓
网址:http://m.1010jiajiao.com/timu3_id_187421[举报]
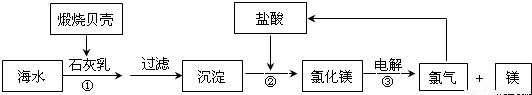
目前,世界上生产的镁有60%来自海水,其生产流程图如图
(1)贝壳的主要化学成分为
(2)写出反应②的离子方程式:
(3)写出Mg与CO2反应的化学方程式,并标出电子转移的方向与数目:
 ;其中还原剂是
;其中还原剂是
(4)电解氯化镁所得的氯气除用于生产盐酸外,请举出氯气在工业上的另一种用途(用化学方程式表示)
查看习题详情和答案>>

(1)贝壳的主要化学成分为
CaCO3
CaCO3
(写化学式);(2)写出反应②的离子方程式:
Mg(OH)2+2H+=Mg2++2H2O
Mg(OH)2+2H+=Mg2++2H2O
;(3)写出Mg与CO2反应的化学方程式,并标出电子转移的方向与数目:


Mg
Mg
;被还原的元素为C
C
.(4)电解氯化镁所得的氯气除用于生产盐酸外,请举出氯气在工业上的另一种用途(用化学方程式表示)
2Ca(OH)2+2Cl2═2H2O+CaCl2+Ca(ClO)2
2Ca(OH)2+2Cl2═2H2O+CaCl2+Ca(ClO)2
.目前,世界上生产的镁有60%来自海水.从海水中提取镁,最基本的方法就是向海水中加碱使镁沉淀出来,然后经过一系列处理,最终得到单质镁.在从海水中提取镁的过程,没有发生的反应是( )
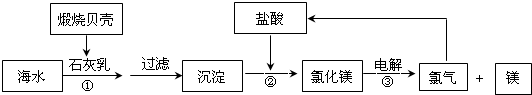
目前,世界上生产的镁有60%来自海水,其生产流程图如下
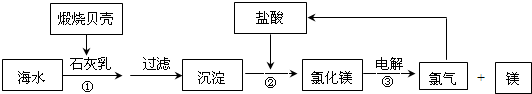
(1)贝壳的主要化学成分为 (写化学式);
(2)写出反应②的离子方程式:
(3)写出Mg与CO2反应的化学方程式,并标出电子转移的方向与数目: 其中还原剂是
(4)电解氯化镁所得的氯气除用于生产盐酸外,请举出氯气在工业上的另一种用途(用化学方程式表示)
.
查看习题详情和答案>>

(1)贝壳的主要化学成分为
(2)写出反应②的离子方程式:
(3)写出Mg与CO2反应的化学方程式,并标出电子转移的方向与数目:
(4)电解氯化镁所得的氯气除用于生产盐酸外,请举出氯气在工业上的另一种用途(用化学方程式表示)
 Mg+Cl2↑
Mg+Cl2↑ 2Mg+O2↑
2Mg+O2↑