题目内容
目前,世界上生产的镁有60%来自海水,其生产流程图如图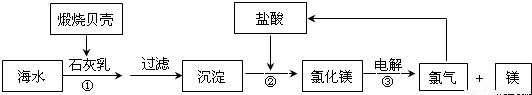
(1)贝壳的主要化学成分为 (写化学式);
(2)写出反应②的离子方程式: ;
(3)写出Mg与CO2反应的化学方程式,并标出电子转移的方向与数目: ;其中还原剂是 ;被还原的元素为 .
(4)电解氯化镁所得的氯气除用于生产盐酸外,请举出氯气在工业上的另一种用途(用化学方程式表示) .
【答案】分析:(1)贝壳的主要化学成分为碳酸钙;
(2)根据流程图可知反应②是氢氧化镁沉淀与盐酸反应;
(3)在氧化还原反应中,化合价升高元素失电子,化合价降低元素得到电子,得失电子数相等即为转移电子数;化合价降低元素在反应中被还原,化合价升高元素所在的反应物是还原剂;
(4)利用氯气与石灰乳制取漂白粉.
解答:解:(1)贝壳的主要化学成分为碳酸钙,故答案为:CaCO3;
(2)反应②是氢氧化镁沉淀与盐酸反应,方程式为:Mg(OH)2+2HCl=MgCl2+2H2O,离子方程式为:Mg(OH)2+2H+=Mg2++2H2O,
故答案为:Mg(OH)2+2H+=Mg2++2H2O;
(3)在氧化还原反应2Mg+CO2 2Mg0+C中,镁元素化合价升高,被氧化,作还原剂,碳元素化合价降低,被还原,作氧化剂,得失电子数相等为4,电子转移情况如下:
2Mg0+C中,镁元素化合价升高,被氧化,作还原剂,碳元素化合价降低,被还原,作氧化剂,得失电子数相等为4,电子转移情况如下: ,故答案为:
,故答案为: ;Mg;C;
;Mg;C;
(4)利用氯气与石灰乳制取漂白粉,方程式为:2Ca(OH)2+2Cl2═2H2O+CaCl2+Ca(ClO)2,
故答案为:2Ca(OH)2+2Cl2═2H2O+CaCl2+Ca(ClO)2.
点评:本题主要考查了镁的制备流程,涉及到氧化还原反应的知识,注意对应知识的积累.
(2)根据流程图可知反应②是氢氧化镁沉淀与盐酸反应;
(3)在氧化还原反应中,化合价升高元素失电子,化合价降低元素得到电子,得失电子数相等即为转移电子数;化合价降低元素在反应中被还原,化合价升高元素所在的反应物是还原剂;
(4)利用氯气与石灰乳制取漂白粉.
解答:解:(1)贝壳的主要化学成分为碳酸钙,故答案为:CaCO3;
(2)反应②是氢氧化镁沉淀与盐酸反应,方程式为:Mg(OH)2+2HCl=MgCl2+2H2O,离子方程式为:Mg(OH)2+2H+=Mg2++2H2O,
故答案为:Mg(OH)2+2H+=Mg2++2H2O;
(3)在氧化还原反应2Mg+CO2
 2Mg0+C中,镁元素化合价升高,被氧化,作还原剂,碳元素化合价降低,被还原,作氧化剂,得失电子数相等为4,电子转移情况如下:
2Mg0+C中,镁元素化合价升高,被氧化,作还原剂,碳元素化合价降低,被还原,作氧化剂,得失电子数相等为4,电子转移情况如下: ,故答案为:
,故答案为: ;Mg;C;
;Mg;C;(4)利用氯气与石灰乳制取漂白粉,方程式为:2Ca(OH)2+2Cl2═2H2O+CaCl2+Ca(ClO)2,
故答案为:2Ca(OH)2+2Cl2═2H2O+CaCl2+Ca(ClO)2.
点评:本题主要考查了镁的制备流程,涉及到氧化还原反应的知识,注意对应知识的积累.

练习册系列答案
 小题狂做系列答案
小题狂做系列答案
相关题目

 Mg+Cl2↑
Mg+Cl2↑ 2Mg+O2↑
2Mg+O2↑