摘要:13.6NO+4NH35N2+6H2O 解析:根据氧化还原反应的原理分析.用NH3将NO还原成无毒气体.该气体只能是N2.NO中N(+2)的氮元素,被NH3中N.剩下的氢.氧元素只能结合成水.
网址:http://m.1010jiajiao.com/timu3_id_186064[举报]
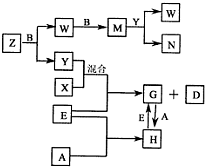 (2012?南充模拟)A、B、C、D、E是五种中学常见的单质,已知A、B、C、D在常温下均为气体.E是地壳中含量居第二位的金属.D可分别跟A、B、C在一定的条件下化合,生成X、Y、Z;Y、Z与Ne的电子数相等,A是第三周期的元素.有关的转化关系如下图所示(反应条件均已略去):
(2012?南充模拟)A、B、C、D、E是五种中学常见的单质,已知A、B、C、D在常温下均为气体.E是地壳中含量居第二位的金属.D可分别跟A、B、C在一定的条件下化合,生成X、Y、Z;Y、Z与Ne的电子数相等,A是第三周期的元素.有关的转化关系如下图所示(反应条件均已略去):(1)A的化学式为
Cl2
Cl2
,B的化学式为O2
O2
,C的电子式为

(2)Z和W在催化剂和加热的条件下反应生成C和Y,这是一个很有意义的反应,可以消除W对环境的污染,该反应的化学方程式为
6NO+4NH3 5N2+6H2O
5N2+6H2O
 5N2+6H2O
5N2+6H2O6NO+4NH3 5N2+6H2O
5N2+6H2O
. 5N2+6H2O
5N2+6H2O(3)将N溶液滴入G的溶液中会产生W,写出上述变化的离子反应方程式:
4H++NO3-+3Fe2+═NO↑+2H2O+3Fe3+
4H++NO3-+3Fe2+═NO↑+2H2O+3Fe3+
.(4)Z与N恰好反应后产物溶解在水中,所得溶液的pH(填“大于”、“小于”或“等于”)
小于
小于
7,用离子反应方程式表示其原因为NH4++H2O NH3?H2O+H+
NH3?H2O+H+
 NH3?H2O+H+
NH3?H2O+H+NH4++H2O NH3?H2O+H+
NH3?H2O+H+
. NH3?H2O+H+
NH3?H2O+H+
在一定条件下,NO与NH3发生如下反应:6NO+4NH3 5N2+6H2O,现有NO和NH3的混合物1 mol,充分反应后,所得产物中,经还原得到的N2比经氧化所得到的N2多
5N2+6H2O,现有NO和NH3的混合物1 mol,充分反应后,所得产物中,经还原得到的N2比经氧化所得到的N2多1.4 g ,若以上反应进行完全,计算原混合物中NO和NH3的物质的量可能是多少。
查看习题详情和答案>>
将16 mL NO和NH3的混合气体在催化剂作用下,400℃左右发生下列反应:6NO+4NH3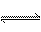 5N2+6H2O。已知反应达平衡后,在相同条件下混合气体的体积变为17 mL,则在原混合气体中,NO和NH3的物质的量之比可能是( )
5N2+6H2O。已知反应达平衡后,在相同条件下混合气体的体积变为17 mL,则在原混合气体中,NO和NH3的物质的量之比可能是( )
①3∶1 ②3∶2 ③3∶4 ④3∶5
A.①② B.①③ C.②③ D.③④
查看习题详情和答案>>