摘要:29.铜和铁是生产.生活中广泛使用的金属. ⑴采用特殊工艺加工.可使普通的铁变成纳米材料.能得到薄得像玻璃纸一样的“铁片 和直径不到头发丝十分之一的“铁丝 .说明铁具有良好的 ▲ . ⑵铜在自然界储量非常丰富.铜的矿物大多具有鲜艳的颜色.如蓝色的蓝铜矿[主要成分化学式为Cu3(CO3)2(OH)2].蓝铜矿主要成分由 ▲ 种元素组成. ⑶金属矿物的储量是有限的.且不能再生.请写出一种保护金属资源的途径 ▲ . ⑷合成气(CO和H2)可用于制备被称为21世纪新型燃料的二甲醚.还可用于冶炼金属.其部分生产过程示意图如下: ①二甲醚(CH3OCH3)可由合成气(CO和H2)在一定的条件下制得.反应过程中CO和H2按分子个数比1:2进行反应.制得二甲醚时.生成的另一种物质是 ▲ . ②根据示意图中标示的物质.合成气在冶炼铁的生产过程中发生反应的化学方程式为 ▲ .
网址:http://m.1010jiajiao.com/timu3_id_18547[举报]
铜和铁是生产、生活中广泛使用的金属.
(1)工业上用一氧化碳和赤铁矿(主要成分是氧化铁)冶炼铁,反应的化学方程式为 .
(2)铁生锈的条件是 ;铜表面也容易生成绿色铜绿,铜锈的主要成分是碱式碳酸铜,化学式为Cu2(OH)2CO3,其组成元素有 种.
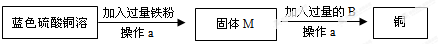
(3)向铜锈中加入过量稀硫酸,固体逐渐溶解,得到蓝色溶液,从蓝色溶液中回收铜的过程如下:

①操作a的名称是 .
②证明B过量方法是 .
③蓝色溶液加入过量铁粉发生反应的化学方程式为 .
查看习题详情和答案>>
(1)工业上用一氧化碳和赤铁矿(主要成分是氧化铁)冶炼铁,反应的化学方程式为
(2)铁生锈的条件是
(3)向铜锈中加入过量稀硫酸,固体逐渐溶解,得到蓝色溶液,从蓝色溶液中回收铜的过程如下:

①操作a的名称是
②证明B过量方法是
③蓝色溶液加入过量铁粉发生反应的化学方程式为
铜和铁是生产、生活中广泛使用的金属.
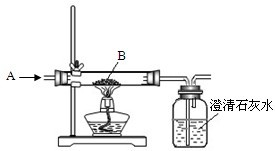
(1)下图是工业炼铁原理的实验示意图.气体A是 和红棕色粉末B是 .广口瓶中可观察到的现象是 ;用化学方程式表示炼铁的反应原理是 ;该实验中尾气的处理方法可以为 .
(2)铁生锈的条件是 ;铜表面也容易生成绿色的铜锈,铜锈的主要成分是碱式碳酸铜,化学式为 .
(3)老师用生锈的铜片、铁粉和稀硫酸进行实验,实验过程如图所示(部分生成物己略去).
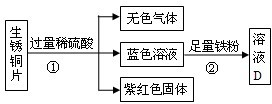
紫红色固体C的化学式为 .写出反应②中反应的化学方程式 .
查看习题详情和答案>>
(1)下图是工业炼铁原理的实验示意图.气体A是

(2)铁生锈的条件是
(3)老师用生锈的铜片、铁粉和稀硫酸进行实验,实验过程如图所示(部分生成物己略去).

紫红色固体C的化学式为
铜和铁是生产、生活中广泛使用的金属.
(1)工业上用一氧化碳和赤铁矿(主要成分是氧化铁)冶炼铁,反应的化学方程式为
(2)铜和铁一样表面也容易生锈,铜锈的主要成分是碱式碳酸铜[化学式为Cu2(OH)2CO3]是铜与空气中氧气、
(3)向铜锈中加入过量稀硫酸,固体逐渐溶解,得到蓝色硫酸铜溶液,从蓝色溶液中回收铜的过程如下:
①操作a的名称是
②证明B过量方法是
③蓝色溶液加入过量铁粉发生反应的化学方程式
查看习题详情和答案>>
(1)工业上用一氧化碳和赤铁矿(主要成分是氧化铁)冶炼铁,反应的化学方程式为
Fe2O3+3CO
2Fe+3CO2
| ||
Fe2O3+3CO
2Fe+3CO2
.
| ||
(2)铜和铁一样表面也容易生锈,铜锈的主要成分是碱式碳酸铜[化学式为Cu2(OH)2CO3]是铜与空气中氧气、
H2O
H2O
及CO2
CO2
(填化学式)共同作用的结果.(3)向铜锈中加入过量稀硫酸,固体逐渐溶解,得到蓝色硫酸铜溶液,从蓝色溶液中回收铜的过程如下:

①操作a的名称是
过滤
过滤
;②证明B过量方法是
加入稀盐酸,有气泡产生
加入稀盐酸,有气泡产生
;③蓝色溶液加入过量铁粉发生反应的化学方程式
Fe+CuSO4=FeSO4+Cu
Fe+CuSO4=FeSO4+Cu
.