题目内容
铜和铁是生产、生活中广泛使用的金属.
(1)工业上用一氧化碳和赤铁矿(主要成分是氧化铁)冶炼铁,反应的化学方程式为
(2)铜和铁一样表面也容易生锈,铜锈的主要成分是碱式碳酸铜[化学式为Cu2(OH)2CO3]是铜与空气中氧气、
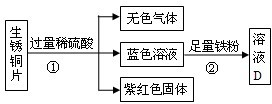
(3)向铜锈中加入过量稀硫酸,固体逐渐溶解,得到蓝色硫酸铜溶液,从蓝色溶液中回收铜的过程如下:
①操作a的名称是
②证明B过量方法是
③蓝色溶液加入过量铁粉发生反应的化学方程式
(1)工业上用一氧化碳和赤铁矿(主要成分是氧化铁)冶炼铁,反应的化学方程式为
Fe2O3+3CO
2Fe+3CO2
| ||
Fe2O3+3CO
2Fe+3CO2
.
| ||
(2)铜和铁一样表面也容易生锈,铜锈的主要成分是碱式碳酸铜[化学式为Cu2(OH)2CO3]是铜与空气中氧气、
H2O
H2O
及CO2
CO2
(填化学式)共同作用的结果.(3)向铜锈中加入过量稀硫酸,固体逐渐溶解,得到蓝色硫酸铜溶液,从蓝色溶液中回收铜的过程如下:

①操作a的名称是
过滤
过滤
;②证明B过量方法是
加入稀盐酸,有气泡产生
加入稀盐酸,有气泡产生
;③蓝色溶液加入过量铁粉发生反应的化学方程式
Fe+CuSO4=FeSO4+Cu
Fe+CuSO4=FeSO4+Cu
.分析:(1)根据炼铁的原理写出反应的方程式;
(2)根据质量守恒定律及空气的成分分析;
(3)①根据从蓝色溶液中回收铜的过程,分析操作a的名称;
②根据铁与酸的反应分析;
③根据硫酸铜与铁的反应,写出反应的方程式.
(2)根据质量守恒定律及空气的成分分析;
(3)①根据从蓝色溶液中回收铜的过程,分析操作a的名称;
②根据铁与酸的反应分析;
③根据硫酸铜与铁的反应,写出反应的方程式.
解答:解:(1)工业上,炼铁的原理是:利用一氧化碳的还原性,将铁从氧化铁中还原出来.反应的方程式是:Fe2O3+3CO
2Fe+3CO2;
(2)由于铜锈的组成元素含有氢、碳元素,结合空气的成分可知:碱式碳酸铜[化学式为Cu2(OH)2CO3]是铜与空气中氧气、H2O 及CO2 共同作用的结果;
(3)①在蓝色溶液中回收铜的过程中,通过操作a从固液混合物中得到了固体,所以,操作a的名称是过滤;
②由于铁与盐酸反应有气泡生成,所以,证明B过量方法是:加入稀盐酸,有气泡产生;
③硫酸铜与铁反应生成了硫酸盐亚铁和铜,反应的方程式是:Fe+CuSO4=FeSO4+Cu.
故答为:(1)Fe2O3+3CO
2Fe+3CO2;(2)H2O、CO2;(3)①过滤;②加入稀盐酸,有气泡产生;③Fe+CuSO4=FeSO4+Cu.
| ||
(2)由于铜锈的组成元素含有氢、碳元素,结合空气的成分可知:碱式碳酸铜[化学式为Cu2(OH)2CO3]是铜与空气中氧气、H2O 及CO2 共同作用的结果;
(3)①在蓝色溶液中回收铜的过程中,通过操作a从固液混合物中得到了固体,所以,操作a的名称是过滤;
②由于铁与盐酸反应有气泡生成,所以,证明B过量方法是:加入稀盐酸,有气泡产生;
③硫酸铜与铁反应生成了硫酸盐亚铁和铜,反应的方程式是:Fe+CuSO4=FeSO4+Cu.
故答为:(1)Fe2O3+3CO
| ||
点评:本题主要考查了常见金属的知识.熟练掌握有关铁、铜的知识,会分析、应用、解决一些问题.

练习册系列答案
相关题目