摘要:11.已知M2O7 x-+ 3S 2-+ 14H+ = 2 M3++ 3S↓+7H2O.则M2O7 x-中的M的化合价为 ( ) A.+2价 B.+3价 C.+4价 D.+6价
网址:http://m.1010jiajiao.com/timu3_id_184487[举报]
第题(分)银制器皿久置会失去光泽,这并不是仅仅由于氧气的作用,是被“流动的水和游荡的风”所侵蚀,经分析,银器失去光泽是由于其表面形成了X ,X可由以下三种方法除去,从而使银器恢复光泽。
① 将银器置于盛有苏打水的铝制器皿中煮沸
② 将银器在KSCN或NH4SCN溶液中放置几分钟
③ 将银器用A的乙醇-水溶液处理数分钟,X与A反应的物质的量比为1:8,A是 NH4SCN的同分异构体,所有原子均只有一种化学环境。
试回答如下问题:
⑴ 给出X 和 A的化学式,并写出生成X的化学方程式
⑵ 写出除去X的三种方法的化学反应方程式
⑶ 计算X 在水中的溶解度,
已知Ksp,X = 6.3×10-50, X的阴离子对应的酸Ka1=9.5×10-8, Ka2=1.0×10-14
⑷ 试判断X在浓度相同的HNO3与HCl中的溶解性大小,说明你的理由
查看习题详情和答案>>已知①R-X+NaCN
R-CN+NaX;
②R-CN
R-COOH.
某高效、低毒的农药K的合成路线如下:(部分无机物已省略)
(1)C→D的反应类型 ;
(2)A的结构简式 ;
(3)写出G→H反应的化学方程式 ;
(4)M的同分异构体有多种,写出具有下列性质的同分异构体的结构简式: ;
①能与FeCl3溶液发生显色反应
②能发生银镜反应
③核磁共振氢谱有四个峰
(5)写出由 制备高分子化合物
制备高分子化合物 的合成路线流程图(无机试剂任选) .
的合成路线流程图(无机试剂任选) .
合成路线流程图示例如下:
查看习题详情和答案>>
| 一定条件下 |
②R-CN
| H2O |
某高效、低毒的农药K的合成路线如下:(部分无机物已省略)

(1)C→D的反应类型
(2)A的结构简式
(3)写出G→H反应的化学方程式
(4)M的同分异构体有多种,写出具有下列性质的同分异构体的结构简式:
①能与FeCl3溶液发生显色反应
②能发生银镜反应
③核磁共振氢谱有四个峰
(5)写出由
 制备高分子化合物
制备高分子化合物 的合成路线流程图(无机试剂任选)
的合成路线流程图(无机试剂任选)合成路线流程图示例如下:
X、Y、Z为原子序数由小到大排列的三种短周期元素.已知:X、Y的气态氢化物分子具有相同的电子数;Y与Z同主族;XY2是非极性分子,其晶体可用作人工降雨.请回答:
(1)写出XY2分子的电子式
 .
.
(2)Z的最高价氧化物对应水化物W是重要的化工原料.W的化学式为
工业制造W的生产过程主要分为三个阶段.
①在 101kPa时,3.2g Z的固体单质完全燃烧可放出29.7kJ的热量,写出能够表示该固体单质燃烧热的热化学方程式
②在接触氧化阶段,为提高ZY2的转化率,从理论上判断,应选择的条件是低温和高压.从下表给出不同温度、压强下ZY2平衡转化率的实验数据进行分析,结合工业生产的实际,应选择的适合的温度和压强是
A.400℃~500℃10MPa
B.400℃~500℃1MPa
C.500℃~500℃10MPa
D.400℃~500℃0.1MPa
③在吸收阶段,为尽可能提高ZY3的吸收效率,工业上选择的吸收剂是(选填字母)
A.水 B.0.5mol/L的硫酸 C.98.3%的硫酸 D.浓氨水
(3)已知X与XY都是工业上常用的还原剂.
①写出X单质与W的浓溶液反应的化学方程式
②500℃,11.2L(标准状况)ZY2在催化剂作用下与XY发生化学反应.若有2×6.02×1023个电子转移时,该反应的化学方程式是
查看习题详情和答案>>
(1)写出XY2分子的电子式


(2)Z的最高价氧化物对应水化物W是重要的化工原料.W的化学式为
H2SO4
H2SO4
.工业制造W的生产过程主要分为三个阶段.
①在 101kPa时,3.2g Z的固体单质完全燃烧可放出29.7kJ的热量,写出能够表示该固体单质燃烧热的热化学方程式
S(s)+O2(g)=SO2(g);△H=-297kJ?mol-1;
S(s)+O2(g)=SO2(g);△H=-297kJ?mol-1;
.②在接触氧化阶段,为提高ZY2的转化率,从理论上判断,应选择的条件是低温和高压.从下表给出不同温度、压强下ZY2平衡转化率的实验数据进行分析,结合工业生产的实际,应选择的适合的温度和压强是
B
B
(选填字母).A.400℃~500℃10MPa
B.400℃~500℃1MPa
C.500℃~500℃10MPa
D.400℃~500℃0.1MPa
| 压强/MPa 转化率/% 温度/℃ |
0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
C
C
.A.水 B.0.5mol/L的硫酸 C.98.3%的硫酸 D.浓氨水
(3)已知X与XY都是工业上常用的还原剂.
①写出X单质与W的浓溶液反应的化学方程式
C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O
| ||
C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O
.
| ||
②500℃,11.2L(标准状况)ZY2在催化剂作用下与XY发生化学反应.若有2×6.02×1023个电子转移时,该反应的化学方程式是
SO2+2CO
S+2CO2
| ||
| △ |
SO2+2CO
S+2CO2
.
| ||
| △ |
(2013?德州一模)海水是应用前景广阔的化工原料资源,从海水中可提取各种化工原料.如图1是工业 上对海水的几项综合利用的示意图(已知气体X为电解饱和食盐水所得;母液苦卤中主要 含有Ca2+、Mg2+,Cl-,SO42?、Br-等离子)请回答: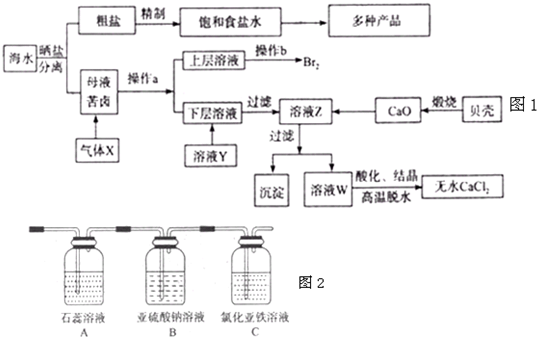
(1)在粗盐中含有Ca2+、Mg2+、SO42-等杂质,梢制时所用的试剂为:A.盐酸B.氯化钡溶 液C.氢氧化钠溶液D.碳酸钠溶液,则加入试剂的顺序是(填编号)
(2)气体X的化学式为
(3)加入溶液Y的目的是
(4)将气体X依次通过如图2所示装置以验证气体X的性质:
①通入气体X后,A中出现的现象是
②C装置中发生反应的离子方程式为
③请你帮该小组同学设计一个实验,证明洗气瓶B中的Na2SO3已被氧化(简述实验步骤)
查看习题详情和答案>>

(1)在粗盐中含有Ca2+、Mg2+、SO42-等杂质,梢制时所用的试剂为:A.盐酸B.氯化钡溶 液C.氢氧化钠溶液D.碳酸钠溶液,则加入试剂的顺序是(填编号)
BDCA 或 CBDA 或BCDA等
BDCA 或 CBDA 或BCDA等
.(2)气体X的化学式为
Cl2
Cl2
,操作a所用的主要仪器是分液漏斗
分液漏斗
.(3)加入溶液Y的目的是
除去溶液中的SO42-
除去溶液中的SO42-
,用CaO调节溶液Z的pH,可以除去Mg2+得到溶液W.由表中数据可知,理论上可选择pH最大范围是11.0≤pH<12.2
11.0≤pH<12.2
.酸化溶液W时,使用的试剂为盐酸
盐酸
.| 开始沉淀时的pH | 沉淀完全时的pH | |
| Mg2+ | 9.6 | 11.0 |
| Ca2+ | 12.2 | c(OH-)=1.8mol?L-1 |
①通入气体X后,A中出现的现象是
溶液先变红,后褪色;
溶液先变红,后褪色;
.②C装置中发生反应的离子方程式为
2Fe2++Cl2═2Fe3++2Cl-
2Fe2++Cl2═2Fe3++2Cl-
.③请你帮该小组同学设计一个实验,证明洗气瓶B中的Na2SO3已被氧化(简述实验步骤)
取少量反应后的溶液于试管中,加入HCl溶液至不再产生气体为止,再滴加BaCl2溶液,如果有白色沉淀生成,证明Na2SO3已被氧化.
取少量反应后的溶液于试管中,加入HCl溶液至不再产生气体为止,再滴加BaCl2溶液,如果有白色沉淀生成,证明Na2SO3已被氧化.
.