摘要:16.VLAl2(SO4)3溶液中含Al3+ 的质量为mg .则溶液中SO42-的物质的量浓度是 A.m/V mol·L-1 B.m/27V mol·L-1 C.m/18V mol·L-1 D.m/54V mol·L-1
网址:http://m.1010jiajiao.com/timu3_id_184373[举报]
等体积的AlCl3溶液和NaOH溶液混合后,若沉淀中含Al的质量与溶液中含Al的质量相等,则AlCl3溶液和NaOH溶液的物质的量浓度之比为
- A.3∶2
- B.2∶4
- C.1∶4
- D.2∶7
|
等体积的AlCl3溶液和NaOH溶液混合后,若沉淀中含Al的质量与溶液中含Al的质量相等,则AlCl3溶液和NaOH溶液的物质的量浓度之比为 | |
| [ ] | |
A. |
3∶2 |
B. |
2∶4 |
C. |
1∶4 |
D. |
2∶7 |
A~I分别表示中学化学中常见的一种物质,其中A、I为常见金属,它们之间的相互关系如图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六各物质中均含同一种元素.
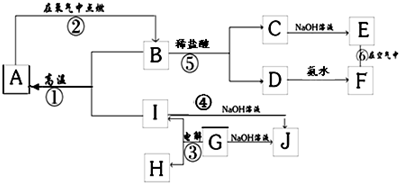
请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含的同一种元素在元素周期表中的位置是
(2)检验C溶液中阳离子的方法是(写出操作,现象及结论)
(3)写出下列反应的化学方程式或离子方程式:
反应①的化学方程式:
反应④的离子方程式:
反应⑥的化学方程式:
(4)从能量变化的角度看,反应①②③中,属于△H<0的反应是
查看习题详情和答案>>

请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含的同一种元素在元素周期表中的位置是
第4周期Ⅷ族
第4周期Ⅷ族
.(2)检验C溶液中阳离子的方法是(写出操作,现象及结论)
取少量溶液于试管中,滴加KSCN溶液,溶液无色,滴加氯水,溶液变为血红色证明C溶液中含Fe2+
取少量溶液于试管中,滴加KSCN溶液,溶液无色,滴加氯水,溶液变为血红色证明C溶液中含Fe2+
.(3)写出下列反应的化学方程式或离子方程式:
反应①的化学方程式:
8Al+3Fe3O4
4Al2O3+9Fe
| ||
8Al+3Fe3O4
4Al2O3+9Fe
;
| ||
反应④的离子方程式:
2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑
2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑
;反应⑥的化学方程式:
4Fe(OH)2+O2+2H2O=4Fe(OH)3
4Fe(OH)2+O2+2H2O=4Fe(OH)3
;(4)从能量变化的角度看,反应①②③中,属于△H<0的反应是
①②
①②
(填序号).(1)0.5mol H2O的质量为
(2)质量都是50g的 H2、Cl2、CO2、O2四种气体中,含有分子数目最少的是
(3)在
(4)中和相同体积、相同物质的量浓度的H2SO4溶液,并使其生成正盐,需要NaOH、Mg(OH)2、Al(OH)3的物质的量之比为
查看习题详情和答案>>
9g
9g
,其中含有0.5NA
0.5NA
个水分子,共有1.5NA
1.5NA
个原子.(2)质量都是50g的 H2、Cl2、CO2、O2四种气体中,含有分子数目最少的是
Cl2
Cl2
,同温同压下,体积最大的是H2
H2
,体积最小的是Cl2
Cl2
.(用化学式表示)(3)在
50
50
mL 2mol/L NaOH溶液中含4g溶质;配制500mL 0.2mol/L CuSO4溶液,需要CuSO4?5H2O25
25
g.(4)中和相同体积、相同物质的量浓度的H2SO4溶液,并使其生成正盐,需要NaOH、Mg(OH)2、Al(OH)3的物质的量之比为
6:3:2
6:3:2
.